回答下列问题:
(1)阅读下图包装说明,这袋化肥中氮元素的质量为 kg;碳酸氢铵的质量为 kg。(结果保留小数点后一位)
(2)欲将50kg10%的碳酸氢铵溶液稀释成1%的溶液,用于农作物的催肥,需加 kg水。
小黄为了测定某稀盐酸溶质的质量分数,将146.0g 的稀盐酸倒入盛有足量锌粉的烧杯中,恰好完全反应,实验过程如图所示。(反应的化学方程式为Zn+2HCl=ZnCl2+H2↑)
试计算:
(1)根据质量守恒定律,可知生成氢气 g。
(2)试计算稀盐酸中溶质的质量分数
氢化钙固体是登山运动员常用的能源提供剂。探究小组在烧杯中放入10g氢化钙样品,再加入到20g水充分搅拌,完全反应后测得烧杯内物质的总质量为29.2g。(已知氢化钙(CaH2)与水反应的化学方程式为:CaH2 + 2H2O  Ca(OH)2 +2 H2↑)
Ca(OH)2 +2 H2↑)
请计算:
(1)生成氢气的质量。
(2)样品中氢化钙的质量分数。
将氢氧化钠和氯化钠的混合物19.3g,放入80.7g水中使其完全溶解,再加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应。试计算:
(1)将上述浓度的稀盐酸100克稀释为溶质质量分数为4%的稀盐酸,需要加入水的质量;
(2)原混合物中氢氧化钠的质量;
(3)反应后所得溶液中溶质的质量。
将1.5 g混有铜粉的镁粉投入100g11.76%的稀硫酸中,至不再产生气泡为止,共收集0.1 g气体。过滤后,向所得溶液滴入质量分数为10%的氢氧化钠溶液。开始滴入时无沉淀生成,滴加一定质量的氢氧化钠溶液后开始出现白色沉淀。当滴加氢氧化钠溶液的质量为80g时,恰好得到最多的沉淀量2.9 g。试求:
(1)原混合物中镁的质量分数;
(2)最终所得溶液中溶质的质量分数。(计算结果保留至0.01%)
(3)请画出平面直角坐标图:要求以氢氧化钠溶液的质量为横坐标,产生沉淀的质量为纵坐标,并且标示出起点、折点的坐标
下表是100 g某食品的部分营养成分(其它成分不能提供热量):
| 总热量 |
蛋白质 |
糖类 |
油脂 |
水 |
钠 |
磷 |
钙 |
|
| 1984 kJ |
50 g |
20g |
待测 |
5g |
4.6 mg |
3.3 mg |
8mg |
|
(1)该食品所含的有机营养素是 __ ;每100 g该食品中所含营养成分质量最大的是 __ 。
(2)上表中钠、磷、钙指的是 (选填“单质”、“元素”、“离子”);
(3)若该食品中的钙以碳酸钙的形式存在,则100 g该食品中,碳酸钙为 mg;
(4)假设食物的总热量是由蛋白质、糖类、油脂提供的,单位质量的蛋白质、糖类、油脂完全氧化放热约为:油脂 38 kJ/ g 、蛋白质 20 kJ/ g、糖类 15 kJ/ g。
根据此数据计算,理论上100 g该食品中油脂的质量为 g。
实验室中有一瓶部分变质了的NaOH溶液,小丽为了测定溶液中溶质的Na2CO3的质量分数,现取20g待测溶液,向其中逐滴加入CaCl2溶液,产生沉淀质量与所加CaCl2质量的关系如图所示。
(1)B点处所得溶液中溶质有 。
(2)若加入的CaCl2溶液的质量分数为11.1%则需该溶液的质量为________
(3)求待测溶液中Na2CO3的质量分数。(写出计算过程)
现有一定质量的甲烷不完全燃烧,生成一氧化碳、二氧化碳和水蒸气的混合气体75g,经测定混合气体中碳元素的质量分数为16%,则参加反应的氧气的质量是
| A.48g | B.56g | C.59g | D.64g |
将m1g碳与m2g氧气置于密闭容器中,在一定条件下充分反应,恢复至常温,若此时密闭容器中的气体是纯净物,则m1∶m2不可能是
| A.1∶1 | B.1∶2 | C.3∶4 | D.3∶8 |
称取—定质量的氯酸钾和二氧化锰,混合后放人大试管中加热至质量不再变化为止。实验测得固体混合物质量随加热时间变化的相关数据如图所示。为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入85.1g水,使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离。请计算: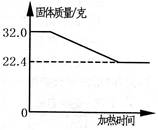
(1)原混合物中氯酸钾的质量分数?
(2)得到的滤液中氯化钾的质量分数(二氧化锰在水中难溶) ?
(1)将3克木炭粉与6克氧气放入一密闭容器中加热到反应不再发生时,容器中的物质是 。
(2)为测定某石灰石样品中碳酸钙的含量,取样品10.0g于烧杯中再向其中加入稀盐酸50.0g恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7克,求石灰石样品中碳酸钙的质量分数
氧化亚铜(Cu2O)可用于船底防污漆,防止海生物对船舶设备的污损。某氧化亚铜样品中含有10%的金属铜,现取4.0g该样品放入烧杯中,加入一定溶质质量分数的稀硫酸恰好完全反应,得到27.0g不饱和溶液。发生反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O
请计算:(1)所取样品中氧化亚铜的质量为________g。
(2)所用稀硫酸溶质的质量分数。
造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定某造纸厂废水中氢氧化钠的质量分数,小明取40g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49g。计算废水中氢氧化钠的质量分数。
为了测定某种大理石废料中碳酸钙的含量,某研究小组的同学取50g该大理石样品,分5次加入200g稀盐酸(假设杂质不与盐酸反应,也不溶于水)进行充分反应。实验过程中的数据记录如下:
| 稀盐酸的质量 |
第一次 40g |
第二次 40g |
第三次 40g |
第四次 40g |
第五次 40g |
| 剩余固体质量 |
40.0g |
30.0g |
20.0g |
10.0g |
5.0g |
(1)写出实验中发生反应的化学方程式___________________________________________;
(2)根据已知条件列出求解50g大理石样品生成二氧化碳质量(x)的比例式__________;
(3)小组同学用质量分数为36.5%的浓盐酸配制200g上述稀盐酸,需要浓盐酸和水的质量比为________;
(4)向第一次反应后所得溶液中加入54.4g水,则所得溶液的溶质质量分数为__________;
(5)某工厂要想制得280t含杂质19%的生石灰,理论上需要这种大理石废料的质量为__________;