环保部门对某工厂的废水进行分析,结果表明:废水中含少量硫酸。取一定量废水用2%的氢氧化钠溶液中和(已知废水中的其它成分不与氢氧化钠反应),至PH等于7时,消耗氢氧化钠溶液质量为40g,同时测得反应后溶液质量为138g。请计算该工厂排放的废水中硫酸的质量分数。
为测定某纯碱样品(含氢氧化钠杂质)中碳酸钠的含量,进行如下实验:取65g纯碱样品平均分为5份,分别加入相同质量分数的稀盐酸溶液,获得如下实验数据:
| 实验 |
1 |
2 |
3 |
4 |
5 |
| 样品质量/g |
13 |
13 |
13 |
13 |
13 |
| 加入盐酸质量/g |
15 |
30 |
80 |
130 |
150 |
| 反应后物质质量/g |
28 |
43 |
90.8 |
138.6 |
158.6 |
(1)13g样品完全反应时放出气体的质量是 g。
(2)纯碱样品中Na2CO3的质量分数是多少?(写出计算过程,结果保留小数点后一位)
(3)13g样品与盐酸恰好完全反应后生成物溶液中溶质的质量分数是 (只写结果,保留小数点后一位)。
(4)若向13g样品中持续不断的加入稀盐酸,请你画出加入稀盐酸与生成气体的质量关系图。(在答题卡的坐标中作图)
回答下列问题:
(1)阅读下图包装说明,这袋化肥中氮元素的质量为 kg;碳酸氢铵的质量为 kg。(结果保留小数点后一位)
(2)欲将50kg10%的碳酸氢铵溶液稀释成1%的溶液,用于农作物的催肥,需加 kg水。
小黄为了测定某稀盐酸溶质的质量分数,将146.0g 的稀盐酸倒入盛有足量锌粉的烧杯中,恰好完全反应,实验过程如图所示。(反应的化学方程式为Zn+2HCl=ZnCl2+H2↑)
试计算:
(1)根据质量守恒定律,可知生成氢气 g。
(2)试计算稀盐酸中溶质的质量分数
氢化钙固体是登山运动员常用的能源提供剂。探究小组在烧杯中放入10g氢化钙样品,再加入到20g水充分搅拌,完全反应后测得烧杯内物质的总质量为29.2g。(已知氢化钙(CaH2)与水反应的化学方程式为:CaH2 + 2H2O  Ca(OH)2 +2 H2↑)
Ca(OH)2 +2 H2↑)
请计算:
(1)生成氢气的质量。
(2)样品中氢化钙的质量分数。
称取—定质量的氯酸钾和二氧化锰,混合后放人大试管中加热至质量不再变化为止。实验测得固体混合物质量随加热时间变化的相关数据如图所示。为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入85.1g水,使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离。请计算: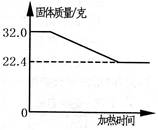
(1)原混合物中氯酸钾的质量分数?
(2)得到的滤液中氯化钾的质量分数(二氧化锰在水中难溶) ?
(1)将3克木炭粉与6克氧气放入一密闭容器中加热到反应不再发生时,容器中的物质是 。
(2)为测定某石灰石样品中碳酸钙的含量,取样品10.0g于烧杯中再向其中加入稀盐酸50.0g恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7克,求石灰石样品中碳酸钙的质量分数
氧化亚铜(Cu2O)可用于船底防污漆,防止海生物对船舶设备的污损。某氧化亚铜样品中含有10%的金属铜,现取4.0g该样品放入烧杯中,加入一定溶质质量分数的稀硫酸恰好完全反应,得到27.0g不饱和溶液。发生反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O
请计算:(1)所取样品中氧化亚铜的质量为________g。
(2)所用稀硫酸溶质的质量分数。
造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定某造纸厂废水中氢氧化钠的质量分数,小明取40g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49g。计算废水中氢氧化钠的质量分数。
为了测定某种大理石废料中碳酸钙的含量,某研究小组的同学取50g该大理石样品,分5次加入200g稀盐酸(假设杂质不与盐酸反应,也不溶于水)进行充分反应。实验过程中的数据记录如下:
| 稀盐酸的质量 |
第一次 40g |
第二次 40g |
第三次 40g |
第四次 40g |
第五次 40g |
| 剩余固体质量 |
40.0g |
30.0g |
20.0g |
10.0g |
5.0g |
(1)写出实验中发生反应的化学方程式___________________________________________;
(2)根据已知条件列出求解50g大理石样品生成二氧化碳质量(x)的比例式__________;
(3)小组同学用质量分数为36.5%的浓盐酸配制200g上述稀盐酸,需要浓盐酸和水的质量比为________;
(4)向第一次反应后所得溶液中加入54.4g水,则所得溶液的溶质质量分数为__________;
(5)某工厂要想制得280t含杂质19%的生石灰,理论上需要这种大理石废料的质量为__________;
国庆前夕,为了给气球充气,王老师与小明到实验室制取氢气,王老师将一定量的锌放入一定量的稀硫酸中,恰好反应,充完气球后,在锥形瓶中得到338g溶液,小明将338g溶液平均分成两等份,做如下实验:一份蒸发8g水,另一份加入2gZnSO4粉末,所得的两份溶液质量分数相等,试问:
(1)上述制取氢气的化学反应方程式为______________________________;
(2)小明配得两份溶液质量分数相等,其质量分数为___________;
(3)设稀硫酸中溶质的质量为X,根据反应后每份338g溶液中溶质的质量,列出求解(X)的比例式_______________________________________;
(4)原稀硫酸的质量分数为____________(结果保留小数点后一位)。
人类的生活和生产都离不开金属材料。
(1)下列物质不属于合金的是 。
| A.青铜 | B.铝 | C.钢 | D.生铁 |
(2)每年因腐蚀而报废掉的金属材料数量惊人,铁生锈的条件是铁与 和 同时接触。
(3)工业炼铁可以把赤铁矿(主要成分为Fe2O3)在高炉里和CO反应,生成单质铁,
该反应的化学方程式是 ;
①氧化铁(Fe2O3)的相对分子质量是 ;
②2000t含氧化铁80%的赤铁矿中理论上可炼得含铁90%的生铁 t(保留一位小数)。
某实验小组为研究碳酸钠和碳酸氢钠混合物的组成做了以下实验:充分加热10.0 g样品至恒重,剩余固体质量为6.9 g。
查阅资料已知:碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳;碳酸钠受热不易分解。
计算:(1)生成二氧化碳的质量。
(2)混合物中碳酸钠的质量分数。
请根据下图所示的实验过程和提供的数据计算: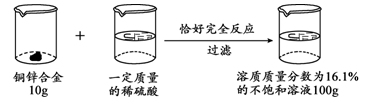
(1)生成氢气的质量。
(2)合金中铜的质量分数。
(3)所加稀硫酸的质量。
食品加工厂在制作馒头等面食时,经常会用到食用小苏打。与工业制取碳酸氢钠不同,食用小苏打是由纯碱溶液和二氧化碳反应制得:
CO2 + H2O + Na2CO3 === 2NaHCO3。
某温度下,向121.2g碳酸钠溶液中通入一定量的CO2至碳酸钠恰好完全反应,反应后的溶液中有碳酸氢钠析出,过滤,分别得到23.96g固体和106.04 g溶液。
请计算:
(1)参与反应的CO2质量。
(2)过滤后的溶液中,碳酸氢钠与水的质量比。