某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如图:
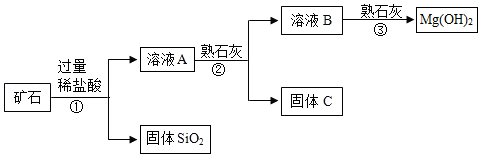
回答下列问题:
(1)步骤①和步骤②均用到的操作是 。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和 (填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 |
Fe3+ |
Cu2+ |
Mg2+ |
开始沉淀时的pH |
1.9 |
4.2 |
9.1 |
完全沉淀时的pH |
3.2 |
6.7 |
11.1 |
步骤②加入熟石灰,调节溶液的pH范围为 ,固体C中所含成分的化学式为 。
(4)步骤③制得Mg(OH)2的化学方程式为 。
碳酸氢铵是一种常用的化学肥料。工业生产碳酸氢铵的一种流程如图所示:
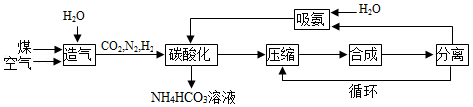
已知:“合成”步骤中发生的反应为N2+3H2 2NH3。
2NH3。
(1)碳酸氢铵属于化肥中的 肥。
(2)“造气”步骤中为加快反应速率,可采取的具体措施有 (写一条即可)。
(3)“碳酸化”步骤的化学方程式为 。该步骤在较低温度下进行的原因是 。
(4)“碳酸化”步骤的作用是制取碳酸氢铵和 。
(5)“循环”的目的是 。
辉铜矿的主要成分为硫化亚铜(Cu2S),工业上用辉铜矿冶铜的一种工艺流程图如下:
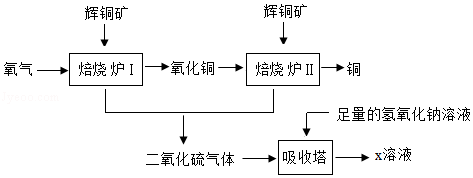
请你回答下列有关问题:
(1)硫化亚铜中铜元素的化合价为 。
(2)焙烧炉Ⅱ中发生反应的化学方程式为 。
(3)二氧化硫与二氧化碳具有相似的化学性质,则x溶液中盐的化学式是 。
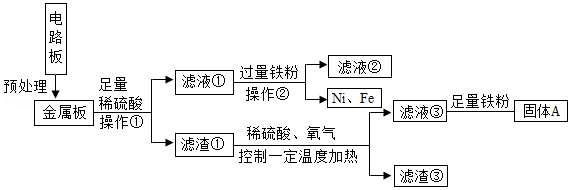
内江拥有中国西南地区最大的再生资源基地,可回收处理大量废旧塑料电器及玻璃等,某品牌电器的废旧电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属) 等金属,如下图是某车间回收部分金属的工艺流程。已知,2Cu+O2+2H2SO4 2CuSO4+2H2O。
2CuSO4+2H2O。
回答下列问题。
(1)操作①中,使用的玻璃仪器除烧杯、玻璃棒外,还需 ;
(2)滤渣③中含有的金属是 ;
(3)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(4)滤液③中加入足量铁粉的主要目的是 ,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为 ;
(5)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是 。
某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:

已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了 现象。步骤①产生的废气B中,一定含有的有害气体是 (填化学式)。环保处理最好釆用的试剂是 (填字母序号)。
A、浓硫酸 B、食盐水 C、石灰乳
(2)写出步骤④中得到铜的化学方程式 ,它属于基本反应类型中的 反应。
(3)步骤③和④中主要操作的名称是 。
(4)我国古代就制得了一种外观似金子的锌和铜的合金,也就是黄铜,它的硬度比纯铜 (填“高”或者“低”)。
(5)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有 (填字母序号)。
A、硫酸镁 B、硫酸锌 C、硫酸铜 D、硫酸铜和硫酸锌
工业上处理黄铜渣(Cu、Zn、ZnO、CuO和杂质)废料时,通常将其转化为硫酸锌和铜等有价产品。其主要流程如图所示(杂质不溶于水也不参与反应):
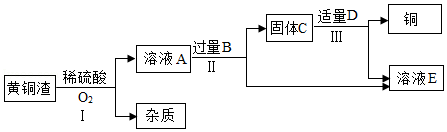
资料:2Cu+2H 2SO 4+O 2 2CuSO 4+2H 2O;ZnO+H 2SO 4═ZnSO 4+H 2O;CuO+H 2SO 4═CuSO 4+H 2O。
(1)物质B的化学式是 。
(2)过程Ⅱ中分离操作的名称是 ,该操作用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称)。
(3)过程Ⅲ中有气体产生,该反应的化学方程式是 。
钛(Ti)被称为“航空金属”。由钛铁矿(主要成今是钛酸亚铁,化学式为FeTiO3)制备钛的一种流程如下:

(1)FeTiO3中钛元素的化合价为 。
(2)“氯化”过程中焦炭的作用是 。
(3)由TiCl4制备Ti的化学方程式为 。该反应在氩气(Ar)氛围中进行的理由是 。
(4)如上述流程所示,将钛厂、氯碱厂和甲醇厂组成产业链的好处是 。
以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如图

注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为 (填化学式)。
(2)实验室中用图一所示装置进行过滤。
①该装置中仪器A的名称为 。
②若过滤时滤液出现浑浊,可能的原因是 (填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3•H2O发生反应。结合图二,写出该反应的化学方程式 。
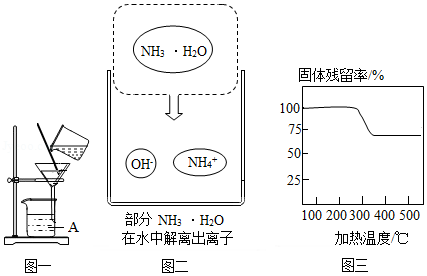
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如题图三所示。“加热”时温度至少要达到350℃,原因是 。
氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3等)为原料制备高纯氧化镁的实验流程如下:

(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、 。MgCO3与盐酸反应的化学方程式为 。
(2)“氧化”过程中。FeCl2转化为FeCl3,该反应属于基本反应类型中的 。
(3)“沉淀”时需严格控制NaOH溶液的用量,其目的是 。
(4)“滤液”中的溶质主要是MgCl2和 。
下列物质的转化在给定条件下均能实现的是( )
A.NaHCO3 Na2CO3 NaOH
B.KMnO4 O2 Cu2(OH)2CO3
C.Na2CO3 Na2SO4 NaCl
D.K2SO4 BaSO4 Ba(NO3)2
绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,下列有关说法或方程式正确的是( )
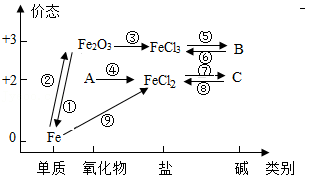
A.物质A的名称是氧化铁
B.①反应可能是Fe2O3+3Al 3AlO+2Fe
3AlO+2Fe
C.⑤反应可能是FeCl3+3NaOH═Fe(OH)3↓+3NaCl
D.⑤~⑨全部是复分解反应
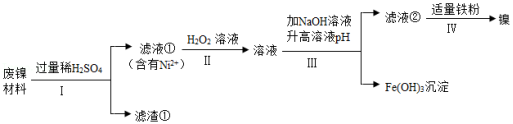
某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图所示(部分产物略去)
查阅资料:a.H 2O 2溶液可将Fe 2+转化为Fe 3+。
b.Fe 3+、Ni 2+转化为对应的氢氧化物沉淀时,溶液pH有如图关系:

(1)步骤Ⅰ的操作为 。
(2)滤渣①的成分为 。
(3)单质Fe参与反应的化学方程式为 (任写一个)。
(4)滤液②中有Ni 2+、无Fe 3+,则滤液②pH可能为 (填序号)。
A.pH=1
B.pH=2
C.pH=6
D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为 。
2021年6月8日是第13个“世界海洋日”。烟台有漫长的海岸线,蕴藏着丰富的海洋资源。某兴趣小组设计的综合利用海水的部分流程图如图。据如图回答:
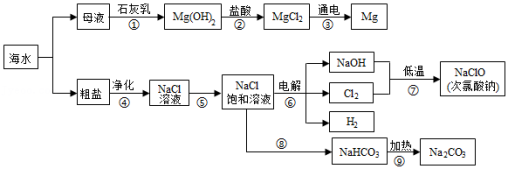
(1)海水制镁,步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是 。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不是向海水中直接加入石灰乳,原因是 。
(2)海水晒盐。通常采用 (填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是 。
(3)海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是 (写化学式)。步骤⑨中发生反应的化学方程式是 。
(4)步骤⑥是电解NaCl饱和溶液制取烧碱,该反应中的反应物是 。
(5)步骤⑦用烧碱低温制取次氯酸钠的反应原理为:Cl2+2NaOH═X+NaClO+H2O,则X的化学式是 。
无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO 2、Fe 2O 3、MgSO 4等杂质)为原料,生产无水氯化钙的流程如图:
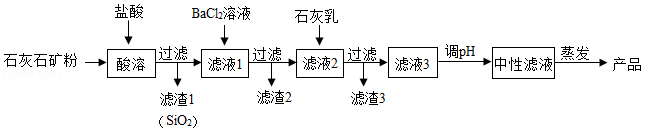
回答下列问题:
(1)从流程图中推知:SiO 2具有的化学性质是 。
(2)氧化铁与盐酸反应的化学方程式为 。
(3)滤渣3中除有Ca(OH) 2外,还有 (填化学式,下同)。
(4)产品中的杂质除极少量H 2O外,最有可能含的是 。