某兴趣小组的同学从实验收集到一桶含有FeSO 4、CuSO 4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题:

(1)固体A中含有 和 ,无色气体X为 H 2 (均填化学式).
(2)步骤①中反应的化学方程式为 ,该反应属于四种基本类型中的 反应.
(3)操作a的名称为 ,在该操作中用到了玻璃棒其作用为 .
(4)理论上所得硫酸亚铁晶体的质量 (填">""<"或"=")原废液中硫酸亚铁的质量.
氯化镁是一种重要的化工原料,同学们在实验室对其开展了系列研究.
课题1:选择制取氯化镁的原料
【查阅资料】
①全球海水中含有的盐类总质量为5亿吨,其中含有的各种离子占盐类总质量的百分含量如下表所示:
离子 |
Cl﹣ |
Na+ |
Mg2+ |
Ca2+ |
K+ |
其他 |
含量 |
55.06% |
30.61% |
3.69% |
1.15% |
1.10% |
… |
②工业生产中海水或卤水(海水晒盐后的剩余溶液)都可以作为制取氯化镁的原料.
【交流讨论】
同学们经讨论,一致选择卤水用于实验室制取氯化镁.你认为他们的理由是
.
课题2:由卤水制取氯化镁
同学们设计如图所示方案,从卤水中制取氯化镁.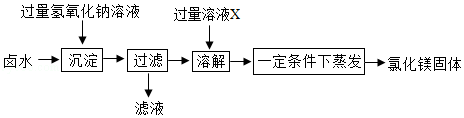
(1)溶液X的名称是 .
(2)部分同学认为上述制取方案不够完善,在“过滤”操作后缺少“洗涤”操作,从而导致制取的氯化镁不纯,可能混有的杂质是 .
课题3:测定氯化镁产品的纯度(氯化镁的质量分数)
同学们设计如下实验方案对制得的氯化镁进行纯度测定.
【实验步骤】
①称取9.5g氯化镁样品,放于烧杯中,加足量的水溶解,形成溶液;
②向上述溶液中加入90g质量分数为10%的氢氧化钠溶液;
③充分反应后,过滤;
④…
⑤向所得溶液中加入几滴无色酚酞试液,溶液变红,再逐滴加入10%稀硫酸(密度为1.07g•mL﹣1),并 ,当观察到溶液恰好褪色且30s内红色不复现,停止加入稀硫酸;
⑥计算氯化镁样品的纯度.
【问题讨论】
(1)为计算出氯化镁样品的纯度,除上述数据外,实验还需测量的数据是 .
(2)若缺少步骤④,则会导致氯化镁纯度测定不准确,步骤④的操作是 .
工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图
(1)“转化”时在溶液中生成了FeCO3沉淀,从四种基本反应类型来看,该反应的类型是 ;“过滤”后得到的滤液中的溶质有 (填化学式)
(2)“干燥”过程中有少量的FeCO3转化为FeOOH和CO2,此时与FeCO3反应的物质有 (填化学式);FeCO3和FeOOH在空气中焙烧转化为Fe2O3,写出Fe2O3在高温条件下与C反应生成Fe和CO2的化学方程式 。
(3)制得的还原铁粉中含有Fe和少量FexC.为确定FexC的化学式,进行了如下实验:
①取14.06g还原铁粉在氧气流中充分加热,得到0.22g CO2;
②另取相同质量的还原铁粉与足量稀硫酸充分反应(FexC与稀硫酸不反应),得到0.48g H2.FexC的化学式是 。
闪锌矿(主要成分为ZnS)经熔烧得锌熔砂,锌熔砂主要含ZnO、ZnFe 3O 4,以及少量FeO、CuO,工业上用其制备金属锌,具体过程如图所示。
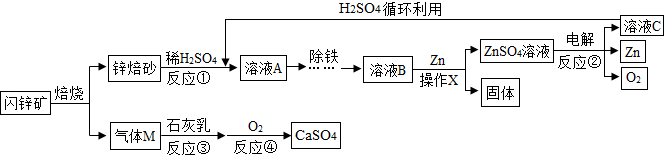
(1)操作X的名称是 ;
(2)进行反应①时,要将锌熔砂粉粹成细小颗粒,目的是 ;
(3)ZnFe 2O 4可看作两种氧化物的结合,它与稀H 2SO 4反应生产两种盐,分别是ZnSO 4和 (填化学式)。
(4)参加反应②的物质为ZnSO 4和 (填化学式);
(5)写出反应③的化学方程式: 。
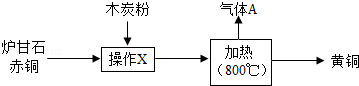
我国古代以炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料制得了黄铜(铜和锌的合金,外观似黄金),其生产流程如下:
回答下列问题:
(1)赤铜中铜元素的化合价
(2)黄铜的硬度比铜和锌都 (填“大”或“小”)
(3)操作X的名称是
(4)加热时,发生的主要反应化学方程式为:①ZnCO3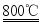 ZnO+CO2↑;②2ZnO+C
ZnO+CO2↑;②2ZnO+C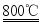 2Zn+CO2↑;③ (赤铜和木炭粉反应)
2Zn+CO2↑;③ (赤铜和木炭粉反应)
(5)气体A中,除二氧化碳外还有另一种生成气体,它的化学式是 ,该气体的用途是 (写一条)
(6)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是 。
某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O 2+2H 2SO 4  2CuSO 4+2H 2O
2CuSO 4+2H 2O
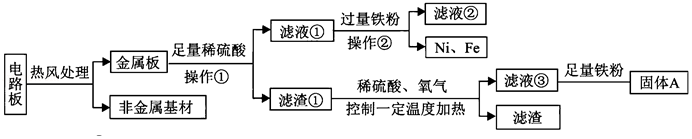
(1)操作①的名称是 。
(2)写出滤液②中金属阳离子符号 。
(3)写出滤液③和铁粉发生反应的一个化学方程式 。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是 。
某兴题小组用铝箔制备A1 2O 3及明矾大晶体,具体流程如下:
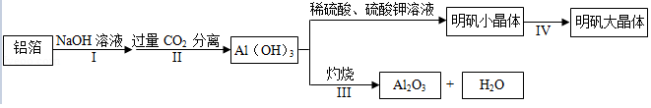
已知:明矾在水中的溶解度随着温度的升高而增大,请回答下列问题:
(1)步骤II中发生反应的化学方程式为:NaAlO 2+CO 2+2H 2O═Al(OH) 3↓+X(方程式已配平)。X的化学式为 。
(2)步骤III中发生的反应,其基本反应类型为 。
(3)写出Al(OH) 3与硫酸反应的化学方程式 。
(4)在培养明矾大晶体的过程中,其操作的先后顺序为 。
A.自然冷却至室温
B.选规则明矾小晶体,并用一根细线悬挂在溶液中央
C.配制45℃的明矾饱和溶液
(5)写出明矾的一种用途 。
某废酸液主要含 H 2 SO 4 和 FeSO 4 ,研究人员利用 CaCO 3 消耗部分酸,再加入廉价的电石渣(主要成分为 CaO ),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如图:

(1)该废酸液的pH 7(填"<"或">")。操作Ⅰ的名称为 。
(2)电石渣转化为石灰乳的过程会 (填"吸收"或"放出")热量。
(3)"沉铁"过程中,溶液中的 FeSO 4 和石灰乳中的 Ca ( OH ) 2 发生复分解反应,生成的产物是 和 (填化学式)。
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为 。
(5)研究发现,"沉铁"后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 ,pH较低时产率较低的主要原因是 。
| 溶液的pH |
6.0 |
6.5 |
7.0 |
7.5 |
8.0 |
9.0 |
| 产物颜色 |
黄褐色 |
黄褐色 |
较黑 |
很黑 |
很黑 |
灰黑色 |
| 产率(%) |
43.9 |
50.6 |
86.2 |
93.0 |
92.3 |
91.6 |
某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe 2O 3)。用该废渣制取CaCl 2晶体(CaCl 2•xH 2O)并进行组成测定,其制取的流程如图1所示:
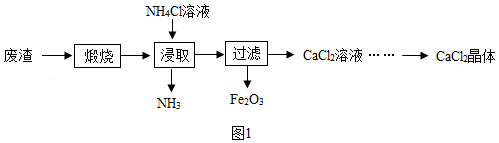
已知:NH 4Cl溶液显酸性,且浓度越高酸性越强
(1)XRD图谱可用于判断某固态物质是否存在。图2为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式 。

(2)浸取时需连续搅拌,其目的是 ;生成的NH 3能使湿润的红色石蕊试纸变 色。
(3)在其它条件相同的情况下,CaCl 2的产率随浸取温度的变化如图3所示。则宜选择的浸取温度为 ℃左右。
(4)若使用过量浓度较高的NH 4Cl溶液,则所得CaCl 2溶液中会含有NH 4Cl、 (填化学式)等杂质。
(5)过滤得到的Fe 2O 3在高温下可与CO反应,写出该反应的化学方程式 。
(6)测定晶体(CaCl 2•xH 2O)的组成:
a.称取14.7000g CaCl 2晶体于锥形瓶内,加入适量蒸馏水。使其全部溶解。
b.再向其中加入足量的Na 2CO 3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。 。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加 ,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值 (填"偏大"、"偏小"或"不变")。
今年春节期间播出的《舌尖3》,让籍籍无名的章丘铁锅名声大振,章丘手工铁锅制造需要历经十二道工序,再过十八遍火候,一千度高温锤炼,经受三万六千次锻打,其炉渣中主要含FeO、Fe2O3,还有一定量既不溶于水,也不与稀酸反应的杂质。现按如图工艺流程,用炉渣制备绿矾(FeSO4•7H2O)。请按要求回答问题:

查阅资料:氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
(1)步骤一中,发生反应的化学方程式为 、 。
(2)步骤一中的操作名称是 ,为提高步骤一的反应速率,可采取的措施有增大硫酸的浓度,升高反应物的温度、还可以采取 (写1条,不考虑“搅拌”和“使用催化剂”)。
(3)步骤二中无气体生成的化学反应方程式为 ,测得滤液2的pH明显大于滤液1,其原因是 。
(4)滤液2得到绿矾可以采取的方法是 。
(5)某化学兴趣小组在实验室中利用该炉渣按照上述工艺流程制取绿矾。现取100g炉渣,得到干燥杂质5g,步骤二中加入15.6g铁粉,得到滤渣5.6g。要计算理论上制得绿矾的质量,除要利用上述给定的全部数据外,在实验过程中,还需测定的一个数据是 。