某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe 2O 3)。用该废渣制取CaCl 2晶体(CaCl 2•xH 2O)并进行组成测定,其制取的流程如图1所示:
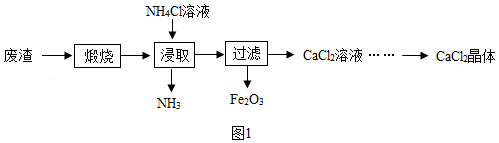
已知:NH 4Cl溶液显酸性,且浓度越高酸性越强
(1)XRD图谱可用于判断某固态物质是否存在。图2为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式 。

(2)浸取时需连续搅拌,其目的是 ;生成的NH 3能使湿润的红色石蕊试纸变 色。
(3)在其它条件相同的情况下,CaCl 2的产率随浸取温度的变化如图3所示。则宜选择的浸取温度为 ℃左右。
(4)若使用过量浓度较高的NH 4Cl溶液,则所得CaCl 2溶液中会含有NH 4Cl、 (填化学式)等杂质。
(5)过滤得到的Fe 2O 3在高温下可与CO反应,写出该反应的化学方程式 。
(6)测定晶体(CaCl 2•xH 2O)的组成:
a.称取14.7000g CaCl 2晶体于锥形瓶内,加入适量蒸馏水。使其全部溶解。
b.再向其中加入足量的Na 2CO 3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。 。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加 ,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值 (填"偏大"、"偏小"或"不变")。
今年春节期间播出的《舌尖3》,让籍籍无名的章丘铁锅名声大振,章丘手工铁锅制造需要历经十二道工序,再过十八遍火候,一千度高温锤炼,经受三万六千次锻打,其炉渣中主要含FeO、Fe2O3,还有一定量既不溶于水,也不与稀酸反应的杂质。现按如图工艺流程,用炉渣制备绿矾(FeSO4•7H2O)。请按要求回答问题:

查阅资料:氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
(1)步骤一中,发生反应的化学方程式为 、 。
(2)步骤一中的操作名称是 ,为提高步骤一的反应速率,可采取的措施有增大硫酸的浓度,升高反应物的温度、还可以采取 (写1条,不考虑“搅拌”和“使用催化剂”)。
(3)步骤二中无气体生成的化学反应方程式为 ,测得滤液2的pH明显大于滤液1,其原因是 。
(4)滤液2得到绿矾可以采取的方法是 。
(5)某化学兴趣小组在实验室中利用该炉渣按照上述工艺流程制取绿矾。现取100g炉渣,得到干燥杂质5g,步骤二中加入15.6g铁粉,得到滤渣5.6g。要计算理论上制得绿矾的质量,除要利用上述给定的全部数据外,在实验过程中,还需测定的一个数据是 。