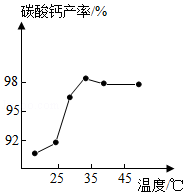
柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
(1)写出反应1的化学方程式: ,该反应属于基本反应类型中的 反应;
(2)操作1的名称为 ;
(3)写出反应2的化学方程式: ;
(4)反应3中会有气体生成,该气体是 ;
(5)柠檬酸亚铁的化学式为FeC6H6O7,柠檬酸亚铁中铁元素和碳元素质量比为 .
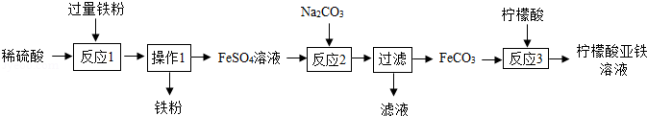
生物浸出技术在金属冶炼中应用广泛。嗜热细菌在65~80℃酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分CuFeS 2)产生硫酸盐,进而制取补血剂原料碳酸亚铁并回收铜。主要流程如图:
(1)黄铜矿的主要成分CuFeS 2中,Fe、Cu的化合价均为+2,则S的化合价为 。配平化学方程式:4CuFeS 2+17O 2+2H 2SO 4  xCuSO 4+yFe 2(SO 4) 3+zH 2O,x、y、z依次为 。
xCuSO 4+yFe 2(SO 4) 3+zH 2O,x、y、z依次为 。
(2)废铁屑与混合溶液发生的反应有:Fe+Fe 2(SO 4) 3═3FeSO 4,该反应所属基本类型是 ;另一反应的化学方程式是 。
(3)操作Ⅰ包括:①过滤,②洗涤,③加足量稀硫酸,④干燥。正确的操作顺序是 (填序号)。在实验室,过滤所用的玻璃仪器有 。
(4)操作Ⅱ需加入一种试剂实现其转化,该试剂可以是 (填化学式)。
(5)若所用废铁屑含有少量铁锈,对产品纯度有无影响? 。
海水中含有氯化钠、氯化镁等可溶性盐,利用海水制取金属镁的流程如图:
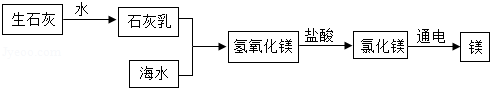
(1)该流程中没有涉及到的基本反应类型是 。
(2)从海水中提取氯化镁时,经历了“氯化镁→氢氧化镁→氯化镁”的转化过程,这样做的目的是 。
某氮肥厂用煤、空气和水为原料合成氨,其工艺流程如图:
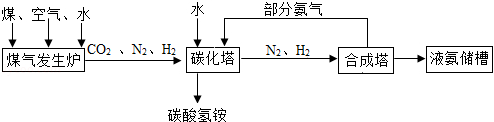
请你回答下列有关问题:
(1)煤气发生炉中发生的化学方程式为
①C+O2 CO2②C+2H2O
CO2②C+2H2O 2H2+CO2
2H2+CO2
其中反应②所属的基本反应类型为 。
反应①的主要作用是(填编号) 。
A.提供二氧化碳 B.提供氧气 C.提供一氧化碳 D.提供热量
(2)部分氨气通入碳化塔的目的是为了除去二氧化碳,同时得到副产品碳酸氢铵,其生成碳酸氢铵反应的化学方程式为 。
为了防止污染,用黄铜矿(主要成分是 CuFeS2及少量含Zn的化合物)炼铜时,将产生的废气、废液转换成工业原料,设计流程如下:(假定每一步都完全反应)

(1)废气处理后得到的产品X是 。
(2)写出步骤①中反应的化学方程式 。
(3)步骤②的操作是 。
(4)滤液a和滤液b中溶质的成分 (填“相同”或“不相同”)。
(5)若操作过程中物质的损失忽略不计,要生成2.8g B和3.2g D,则加入Zn的质量应至少大于 g。
已知A~E分别是铁、氢氧化钙、盐酸、碳酸钠、氯化铜中的一种,A与B反应能生成气体,E的溶液呈蓝色。它们相互之间的关系如图所示,“—”表示两种物质之间可以相互反应。请回答下列问题:
(1)E物质的化学式为 ;
(2)B与D反应的实验现象是 ;
(3)B和C反应的实质是 ;
(4)写出A与C反应的化学方程式 ,其基本反应类型是 。

重庆多地曾出现过盐井,从天然盐井中获取粗盐(含泥沙、CaCl2、MgCl2、Na2SO4等杂质)。为了除去以上杂质得到精盐,小明设计如下实验:
【提示】杂质含量较少,不考虑微溶物形成沉淀。
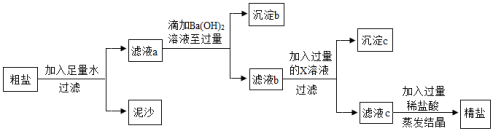
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(2)沉淀b所含物质为Mg(OH)2和 。
(3)物质X是 。
(4)滤液c中加入稀盐酸后发生中和反应的化学方程式为 。
(5)为了证明滴加的Ba(OH)2溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的有 。
A.Ba(OH)2
B.K2CO3
C.Na2SO4
D.KCl
实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 (4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)