在抗击"新冠肺炎病毒"期间,消毒剂在公共场所进行卫生防疫时发挥着重要作用。二氧化氯(ClO 2)是一种高效、广谱、安全的杀菌消毒剂。以粗盐水(含可溶性杂质MgSO 4、CaCl 2)为原料,制取ClO 2的工艺流程如图:

(1)试剂A为 。
(2)加入过量Na 2CO 3溶液的作用是 。
(3)步骤④中发生反应的化学方程式为 。
(4)步骤⑤涉及的物质中含氯元素化合价最高的物质是 。
(5)如图流程中可循环利用的物质有 。
海洋是人类宝贵的自然资源,海水“制盐”体现了人类利用化学科学征服和改造自然的智慧。通过晾晒海水,可以得到粗盐,粗盐中含有不溶性杂质(如泥沙等)和可溶性杂质(如MgCl2、CaC12等),工业上以粗盐为原料制取精盐,其生产流程如图所示
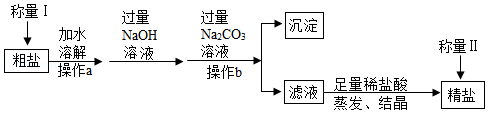
请回答下列问题:
(1)操作b中玻璃棒的作用是 。
(2)加入Na2CO3溶液除去的离子是 (填离子符号),加入NaOH溶液发生反应的化学方程式为 ;
(3)滤液中溶质的主要成分是 (填化学式),加入足量稀盐酸的目的是 。
(4)如果称量Ⅰ中称得粗盐的质量为3g,称量Ⅱ中称得精盐的质量为3.1g,则下列分析正确的是 (填字母)
A.精盐的产率为103.3%
B.蒸发操作中可能有水分没有蒸干
C.除杂过程中有NaCl生成
D.溶解操作中粗盐没有完全溶解
某种手机电路板主要含有Fe、Cu、Ag(银)、Ni(镍)等金属及非金属基材,如图是某工厂回收金属铜的工艺流程图。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O。
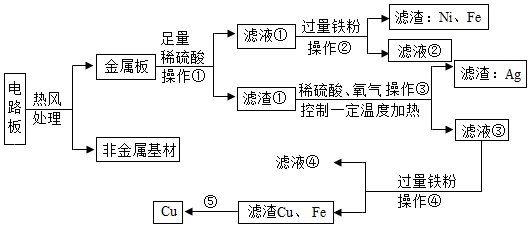
(1)电路板不直接焚烧而采取热风处理的主要目的是 。
(2)操作①的名称是 。
(3)写出滤液③与铁粉反应的化学方程式 。
(4)Fe、Cu、Ag、Ni在溶液中的金属活动性顺序由强到弱依次为 。
(5)写出⑤得到纯铜的一种方法 。
分子筛(又称为沸石,主要成分为水和硅铝酸钠)可作为催化剂或吸附剂等,以高岭土[主要成分为Al2(Si2O5](OH)4].烧碱等为主要原料生产分子筛的工艺流程如图:

(1)步骤①所得烧渣中主要含有两种固体氧化物,分别为SiO2和 (写化学式)
(2)步骤②加入NaOH溶液前需将烧渣粉碎,其目的是 。
(3)步骤③发生的反应之一是Na2SiO3溶液和通入的CO2气体生成偏硅酸(H2SiO3)沉淀和碳酸氢钠,该反应的化学方程式为 。
(4)上述流程中可以循环利用的物质(水除外)是 。
氯化亚铜CuCl是一种难溶于水和乙醇且在潮湿空气中易变质的物质,广泛应用于冶金、电镀、医药等行业、CuCl的制备流程如图:
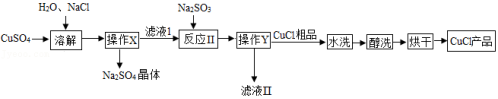
(1)"操作Y"名称是 。
(2)CuCl中铜元素的化合价为 。
(3)请配平"反应Ⅱ"的化学方程式: 。
(4)在"滤液Ⅱ"中可以循环利用的物质(水除外)是 。(填化学式)
(5)"醇洗"的目的是 ,防止后续过程中氯化亚铜变质。
某兴趣小组利用实验室制CO2的废液得到CaCO3和NaCl晶体,过程如下:

(1)试剂X可用 (选填序号)。
a.NaOH溶液 b.Na2CO3溶液 c.K2CO3溶液
(2)操作I需要用到的玻璃仪器有 、 和烧杯。
(3)操作Ⅱ的名称为 。
接触法生产硫酸的工艺流程如图:
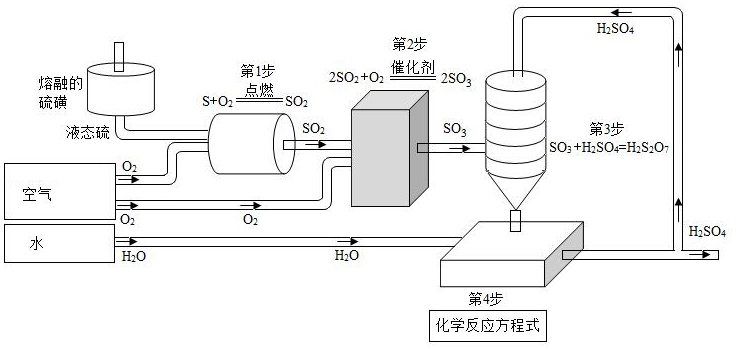
回答下列问题:
(1)第1步反应中将液态硫喷入反应器的目的是 ;
(2)写出第4步化学反应方程式 ;
(3)第1步至第4步流程中涉及到的物质,属于氧化物的有 (用化学式表示);
(4)若用3.2吨硫为原料,则理论上能产出98%的浓硫酸 吨。
工业上,常采用“盐硝联产工艺”生产高纯度食盐,还可以制得硫酸钠。卤水中主要含有NaCl,还含有少量Na2SO4、CaSO4、MgSO4、CaCl2、MgCl2、FeCl3,用火碱和烟道气中的CO2为原料净化卤水,符合低碳经济发展要求。分析流程,回答问题:
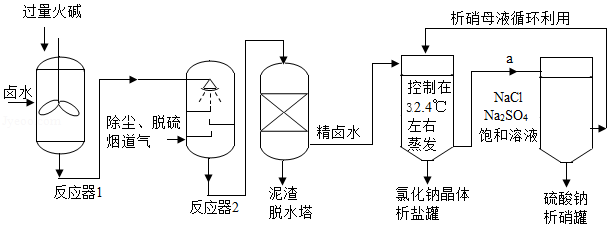
(1)反应器1中主要除去的离子是 (填符号)。
(2)烟道气通入反应器2前要脱硫,是为了除去有害气体 (填化学式)。反应器2中生成沉淀的化学方程式 (写一个)。
(3)下表为NaCl和Na2SO4在不同温度时的溶解度:
温度/℃ |
0 |
10 |
20 |
30 |
32.4 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
溶解度/g |
35.7 |
35.8 |
36.0 |
36.3 |
36.4 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
39.0 |
39.8 |
4.9 |
9.1 |
19.5 |
40.8 |
52.0 |
48.8 |
46.2 |
45.3 |
44.3 |
43.7 |
42.7 |
42.5 |
从析盐罐中排出的溶液a,在温度不变的条件下,每10g水中含有NaCl约 g.为提高Na2SO4纯度,析硝罐中析出Na2SO4,需采用 (填“升温”或“降温”)结晶方法。
从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
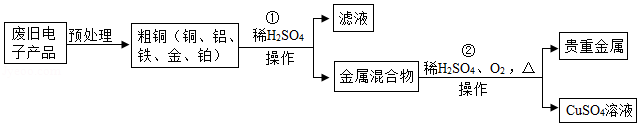
(1)图中“操作”的名称是 。
(2)写出所得贵重金属中任意一种成分的化学式 。
(3)写出①中发生的化学反应方程式 (任写一种);该反应的基本类型为 。
(4)写出②中发生的化学反应方程式 。
海洋是个巨大的宝藏。人类利用海洋化学资源大体上经历了如图1所示几个阶段。

(1)海水经日晒蒸发水分,变为饱和溶液,再晒析出食盐,这一过程叫 ,这样得到的是“粗盐”,不仅含有泥沙,还含有Ca2+、SO42﹣、Mg2+等为去除三种杂质离子,可向粗盐水中依大加入过量的 (填化学式),过滤去除沉淀后再加入适量盐酸,将溶液调至中性。
(2)氯碱工业基本流程(图2):

由图示可知工艺中可循环利用的物质是 。
(3)海水提镁流程:

,写出其中任一个反应的化学方程式 ,提取氯化镁历经 a、b两步转换的目的是 。
(4)下列方法中能淡化海水的是 (填字母)。
A.过滤法 B.沉淀法 C.多级闪急蒸馏法 D.分解法
甲乙丙丁四种物质的转化关系如图所示,回答下列问题。
(1)若甲、丁为单质,则此类反应一定属于 (填一种基本反应类型)。
(2)若丁为水,写出一个符合条件的化学方程式: 。
(3)若丁为蓝色沉淀,则甲可能为 (填一种物质的化学式)

已知:向饱和食盐水中通入氨气得到饱和铵盐水,饱和铵盐水能与CO2发生反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如图:
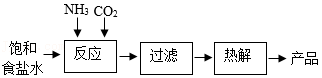
(1)常温时,饱和铵盐水的pH (填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是 。
(2)过滤时,若经两次过滤滤液仍浑浊其原因可能是 (任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为 。
镁及其合金是一种用途广泛的金属材料,大量的金属镁是从海水或卤水中提取的,其主要步骤见如图:
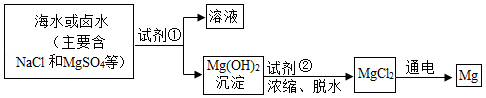
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 ;
(2)加入试剂①后,分离得到Mg(OH)2沉淀的方法是 ;
(3)试剂②可以选用 ;
(4)通电后,MgCl2分解生成Mg和Cl2的化学反应方程式 。
镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水蒸发结晶得到粗盐后的苦卤水中提取的。根据下列工业制镁的主要生产步骤回答问题:
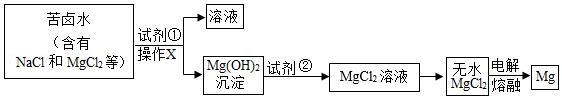
(1)操作X的名称是 ;
(2)试剂②可选用 ;
(3)MgCl2在熔融状态下,通电后会产生金属镁和氯气(Cl2),该反应的化学方程式为 。