硝酸钙可用于无土栽培等。一种利用石灰石制备硝酸钙晶体的流程如图:
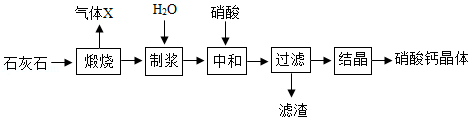
已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”所得的混合物属于 (填字母)。
a.溶液 b.悬浊液 c.乳浊液
(3)写出“中和”步骤主要反应的化学方程式: 。
(4)工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和 。
(5)“制浆”时须控制好加入水的量。加入水量太少会导致制浆困难;加入水量太多会导致 。
(6)若省去“制浆”步骤也可制得硝酸钙。但硝酸利用率会降低,同时会产生污染气体NOx.产生NOx的原因是 。
无水氯化钙(CaCl 2)是重要的干燥剂,CaCl 2•6H 2O与冰的混合物是实验室常用的制冷剂,将CaCl 2•6H 2O加热可得CaCl 2.某工厂以石灰石为原料生产无水氯化钙的流程如图所示,原料石灰石中含有的杂质主要是MgCO 3、MgSO 4。

(1)过滤和蒸发均用到的玻璃仪器是 。
(2)石灰石溶解时,杂质MgCO 3发生反应的化学方程式为 ,该反应是 (填基本反应类型)
(3)加入BaCl 2溶液除去的杂质离子是 ,加入氢氧化钙溶液除杂的化学方程式为 。
(4)由CaCl 2•6H 2O得到CaCl 2是 变化(填"物理"或"化学")。
中国古代四大发明之一的"黑火药"是由木炭(C)、硫粉(S)和硝酸钾(KNO 3)按一定比例混合而成。
(1)分类。下列关于"黑火药"说法正确的是 。
a."黑火药"由"黑火药分子"构成
b."黑火药"中的KNO 3属于复合肥料
c."黑火药"中的C、S不再保持各自的化学性质
(2)变化。"黑火药"爆炸时发生的主要反应是:S+2KNO 3+3C═K 2S+N 2↑+3 ↑。
①依据质量守恒定律,空格上缺少的物质是 (填化学式)。
②"黑火药"爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为 。
(3)制备。古代曾用硝土(含有Ca(NO 3) 2、少量NaCl等)和草木灰(含有K 2CO 3)作原料制取KNO 3.某化学兴趣小组设计了如图实验流程:
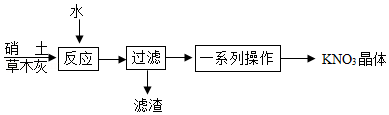
①"反应"过程中的化学方程式为 。
②"过滤"操作必须用到的玻璃仪器有烧杯、玻璃棒和 。
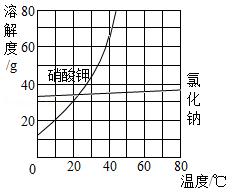
③如图是硝酸钾和氯化钠的溶解度曲线。"一系列操作"包括"加热蒸发浓缩、再冷却到一定温度、过滤"等步骤。其中"冷却到一定温度"能获得纯度较高的硝酸钾晶体的原因是 。
(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C 3H 5O 9N 3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为 。
合成硝化甘油的化学方程式为C 3H 8O 3+3HNO 3═C 3H 5O 9N 3+3H 2O.现用46kg甘油(C 3H 8O 3)和足量硝酸反应,理论上能生成多少硝化甘油?(写出计算过程)
已知:向饱和食盐水中通入氨气得到饱和铵盐水,饱和铵盐水能与CO2发生反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如图:
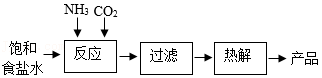
(1)常温时,饱和铵盐水的pH (填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是 。
(2)过滤时,若经两次过滤滤液仍浑浊其原因可能是 (任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为 。
以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的主要工艺流程如图:
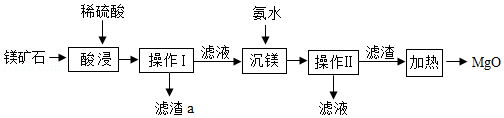
已知:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)操作Ⅰ、Ⅱ的名称是 。
(2)滤渣a的主要成分是 (填化学式)。
(3)“酸浸”时稀硫酸与镁矿石主要成分发生反应的化学方程式是 。
(4)“加热”过程中发生 反应(填基本反应类型)。
在抗击"新冠肺炎病毒"期间,消毒剂在公共场所进行卫生防疫时发挥着重要作用。二氧化氯(ClO 2)是一种高效、广谱、安全的杀菌消毒剂。以粗盐水(含可溶性杂质MgSO 4、CaCl 2)为原料,制取ClO 2的工艺流程如图:

(1)试剂A为 。
(2)加入过量Na 2CO 3溶液的作用是 。
(3)步骤④中发生反应的化学方程式为 。
(4)步骤⑤涉及的物质中含氯元素化合价最高的物质是 。
(5)如图流程中可循环利用的物质有 。
某种手机电路板主要含有Fe、Cu、Ag(银)、Ni(镍)等金属及非金属基材,如图是某工厂回收金属铜的工艺流程图。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O。
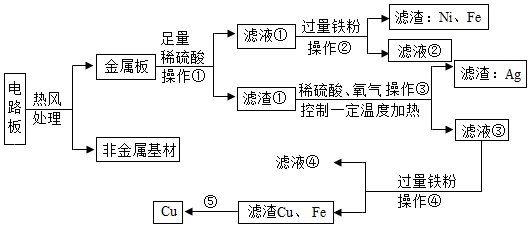
(1)电路板不直接焚烧而采取热风处理的主要目的是 。
(2)操作①的名称是 。
(3)写出滤液③与铁粉反应的化学方程式 。
(4)Fe、Cu、Ag、Ni在溶液中的金属活动性顺序由强到弱依次为 。
(5)写出⑤得到纯铜的一种方法 。
氯化亚铜CuCl是一种难溶于水和乙醇且在潮湿空气中易变质的物质,广泛应用于冶金、电镀、医药等行业、CuCl的制备流程如图:
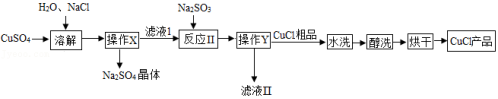
(1)"操作Y"名称是 。
(2)CuCl中铜元素的化合价为 。
(3)请配平"反应Ⅱ"的化学方程式: 。
(4)在"滤液Ⅱ"中可以循环利用的物质(水除外)是 。(填化学式)
(5)"醇洗"的目的是 ,防止后续过程中氯化亚铜变质。
接触法生产硫酸的工艺流程如图:
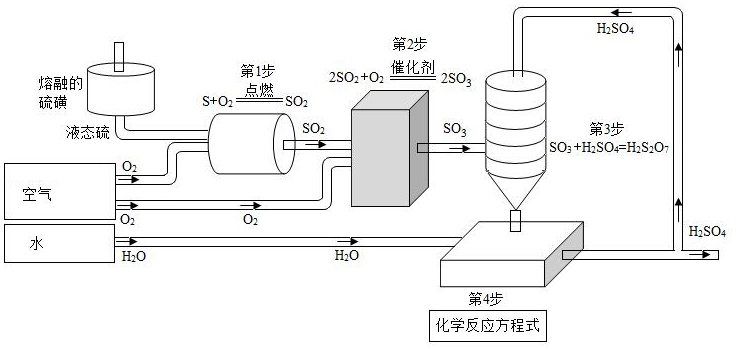
回答下列问题:
(1)第1步反应中将液态硫喷入反应器的目的是 ;
(2)写出第4步化学反应方程式 ;
(3)第1步至第4步流程中涉及到的物质,属于氧化物的有 (用化学式表示);
(4)若用3.2吨硫为原料,则理论上能产出98%的浓硫酸 吨。
从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
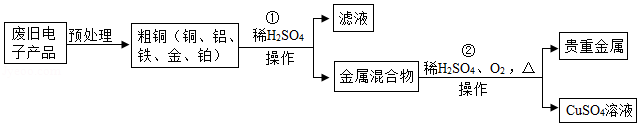
(1)图中“操作”的名称是 。
(2)写出所得贵重金属中任意一种成分的化学式 。
(3)写出①中发生的化学反应方程式 (任写一种);该反应的基本类型为 。
(4)写出②中发生的化学反应方程式 。
“84消毒液”在抗击新冠病毒时可作环境消毒剂,其有效成分为次氯酸钠(NaClO)。如图为一种制取“84消毒液”的简化流程:
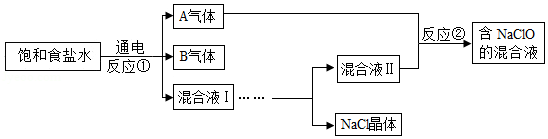
图中A、B气体均为单质,混合液、Ⅰ、Ⅱ的溶质均为NaOH和NaCl。
回答下列问题:
(1)B气体是一种新型能源,也可作燃料。与其它燃料相比,其优点有 (写一点即可)。
(2)反应①的化学方程式为 。
(3)混合液Ⅰ经蒸发浓缩、冷却结晶、 后得到混合液Ⅱ和NaCl晶体。
(4)混合液Ⅱ中的NaOH与A气体发生反应②,产生NaClO、NaCl和H2O,该反应的化学方程式为 。
(5)“84消毒液”与洁厕灵混用时会产生有毒的Cl2,其化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O
对该反应的分析错误的是 (填选项序号)。
a.NaClO、H2O均为氧化物
b.不属于任何基本反应类型
c.只有氯元素的化合价发生了改变
某兴趣小组查阅资料得知:氯酸钾(KClO3) 在加热和二氧化锰做催化剂的条件下生成氯化钾和氧气。他们利用该原理制取氧气,并回收提纯氯化钾和二氧化锰,按以下流程图进行实验,按要求完成下列问题:

(1)步骤Ⅰ中发生反应的化学方程式为 。
(2)步骤Ⅳ中操作Y的名称是 。
(3)步骤Ⅲ中“洗涤”操作2次后,收集第3次的洗涤液并进行检验。取少量洗涤液于试管中,滴加 溶液,有白色沉淀生成,说明还没有洗涤干净。
(4)实验结束后,理论上能够回收得到 克二氧化锰。
镁及其合金是一种用途广泛的金属材料,大量的金属镁是从海水或卤水中提取的,其主要步骤见如图:
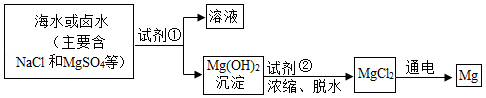
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 ;
(2)加入试剂①后,分离得到Mg(OH)2沉淀的方法是 ;
(3)试剂②可以选用 ;
(4)通电后,MgCl2分解生成Mg和Cl2的化学反应方程式 。
镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水蒸发结晶得到粗盐后的苦卤水中提取的。根据下列工业制镁的主要生产步骤回答问题:
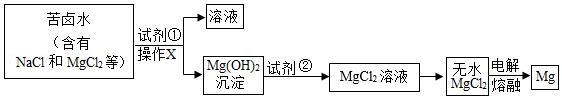
(1)操作X的名称是 ;
(2)试剂②可选用 ;
(3)MgCl2在熔融状态下,通电后会产生金属镁和氯气(Cl2),该反应的化学方程式为 。