利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图(反应条件已略去):
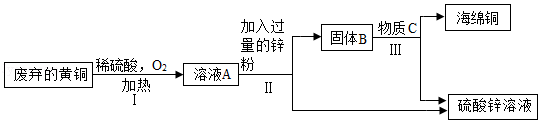
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)过程Ⅱ中加入过量锌粉的目的是 。
(2)过程Ⅲ中有气体产生,所选用的物质C是 (填一种酸)。
海洋中蕴藏着丰富的化学资源,从海水中提取金属镁的主要步骤如图:
资料:海滩贝壳的主要成分是CaCO 3

(1)为节约资源,试剂X常用海滩贝壳为原料制得,则试剂X为 (填化学式);
(2)操作Y的名称为 ;
(3)在熔融状态下的MgCl 2,通电后会生成镁与一种气体单质,该反应的化学方程式为 。
(4)镁常用作合金,一般地合金相对于纯金属,具有的优良特性有 (填序号)。
A.硬度小
B.熔点高
C.抗腐蚀性强
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
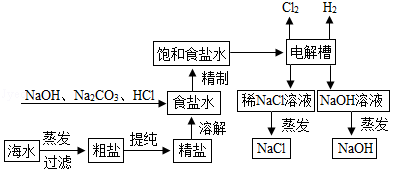
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
①你认为碱样品中含有Na2CO3的原因是 ,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
某工厂产生的废水中含有硫酸锌和少量的硫酸铜以及污泥,为了变废为宝,利用废水制取七水硫酸锌( ZnSO 4•7H 2O),其工艺流程图如下:

回答下列问题:
(1)步骤①的操作名称 .
(2)步骤②需如入过量的物质是 ,目的是 .
(3)步骤③需加入的溶液是 .
(4)步骤④的操作是蒸发浓缩, ,过滤.
(5)如果用ZnSO 4•7H 2O来配制100g 32.2%的硫酸锌溶液,需要 g七水硫酸锌.
自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。①金属镁的物理性质: (写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为 。
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是 ,化学方程式为 。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
苦卤 Mg(OH)2 MgCl2 Mg,流程中X为 。
(4)第四站:再探金属镁。
[提出问题]镁能否与热水反应?如果反应,产物是什么?
[相关信息]①Mg+2H2O=Mg(OH)2+H2↑;②氢氧化镁在热水中能部分溶解。
实验操作 |
实验现象 |
实验结论 |
① ② |
① ② |
镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有 。
氨气(NH 3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH 4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.
(1)下列装置是实验室制取气体的一些发生装置,a仪器为 ,b仪器为 .制取二氧化碳的发生装置是 (填字母序号);制取氨气的发生装置是 (填字母序号),收集氨气的方法是 .
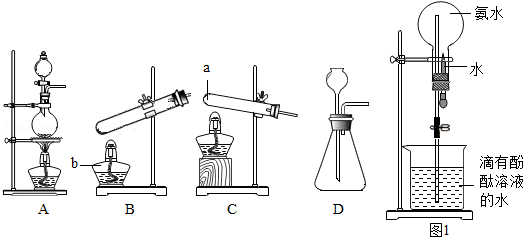
(2)图1是氨气的喷泉实验装置.打开橡皮管上的夹子,将胶头滴管中的水挤入盛满干燥氨气的烧瓶中,因为氨气极易溶于水,烧瓶内的压强降低,烧杯中的水就会进入烧瓶,形成 色的喷泉.
(3)当喷泉实验结束后,测烧瓶内溶液的pH.
步骤如下:
步骤一:用手撕一小段pH试纸,放到干净的玻璃片上.
步骤二:用蒸馏水润湿pH试纸.
步骤三:用玻璃棒蘸取待测液滴到pH试纸上.
步骤四:把试纸显示的颜色与标准比色卡对比,读取pH.
该实验步骤有几处错误? 处,请改正: .
日常生活中使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所填充,其结构如图1所示。某学校化学兴趣小组的同学准备从废旧的干电池中分离出二氧化锰,并制备硫酸锌固体。
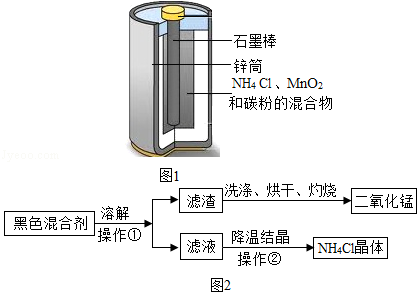
Ⅰ:设计回收二氧化锰的流程如图2所示:
(1)操作①和操作②的名称都是 ,该操作中玻璃棒的作用是 。
(2)上述操作中灼烧滤渣的目的是 。
(3)为了有效回收、利用二氧化锰,小茗同学用回收的二氧化锰与双氧水来制取氧气,请你写出该反应的化学方程式 。
Ⅱ:制备硫酸锌固体的实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应
②将滤液加热浓缩,得到热的饱和溶液
③将上述反应后的混合物过滤
④降温结晶
⑤过滤,得到ZnSO 4•7H 2O晶体
(1)正确的实验操作顺序为(填序号) 。
(2)步骤①中反应的化学方程式 。
Ⅲ:废旧干电池随意丢弃会造成环境污染。请你指出对废旧干电池的处理意见(只填一条): 。
硫酸亚锡(SnSO4)广泛应用于电镀工业。该物质易与氧气反应而变质。实验室模拟工业上制取SnSO4的一种实验方案如下:

(1)SnCl2由Sn与盐酸反应制得,同时生成氢气,该反应的化学方程式为 ↑ 。
(2)Na2CO3俗称 。
(3)过滤所得滤液中的溶质为 (填化学式)。
(4)用已知质量分数和密度的浓硫酸配制质量分数为15%的稀硫酸,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和 。稀释浓硫酸的正确操作为 。
(5)反应2属于基本反应类型中的 反应。从反应2所得溶液中获得SnSO4晶体的部分操作须在隔绝空气条件下进行的原因是 。
回收利用是保护金属资源的一条有效途径,某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液.主要流程如图:

已知:CuO+H 2SO 4═CuSO 4+H 2O Fe+Fe 2(SO 4) 3═3FeSO 4
(1)流程Ⅰ中氧化铁发生反应的化学方程式是 .
(2)流程Ⅲ充分反应后,还应有的实验操作是 .
(3)A﹣E中,含有铁、铜两种元素的是 (填字母).
新冠肺炎疫情防控期间,湘潭市各学校开展全域喷洒低浓度“84”消毒液进行消毒。“84”消毒液的有效成分是NaClO(次氯酸钠),模拟制备“84”消毒液的流程如图所示,其中A是密度最小的气体,B俗称烧碱,Cl2是一种黄绿色的有毒气体。请回答下列问题:
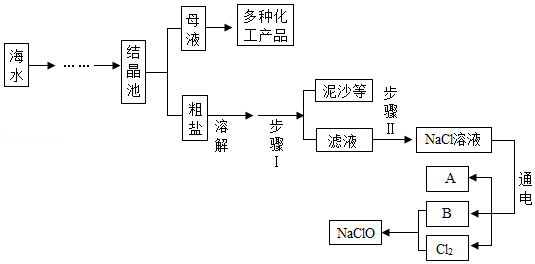
(1)A的化学式为 ,B的化学式为 。
(2)溶解过程中玻璃棒的作用是 ,步骤Ⅰ中主要的操作名称是 。
(3)步骤Ⅱ中,通常用碳酸钠来除去滤液中的氯化钙杂质,请写出有关反应的化学方程式 ,该反应属于 反应(填基本反应类型)。
(4)电解水时,一般在水中加入少量硫酸钠或氢氧化钠的目的是 ,不能加入NaCl的原因是 。
化学在改善人类生存环境,提高生活质量方面起着重要作用。
[改善环境]温室效应和酸雨会威胁珊瑚礁生存,我国开展了南海珊瑚礁生态修复工作。
(1)我们把pH (填“>”、“<”成“=”)5.6的降雨称为酸雨。
(2)为改善生存环境,倡导“低碳”生活,建议使用清洁能源。写出一种常见的清洁能源 。
[探测资源]近期,我国向月球背面成功发射一颗中继通信卫星,助力探测月球资源。
(1)月球上有丰富的核能原料He﹣3,He的原子结构示意图为 (填字母序号)
(2)月球土壤中有天然的铁、铅、银等金属颗粒。根据铁锈蚀的条件分析,铁在月球上不易锈蚀的原因可能是 。
[研发材料]中国芯彰显中国“智”造,芯片的基材主要是高纯硅。
(1)硅元素在元素周期表中的信息如图2所示,据图可得到的信息是 (填字母序号)

A.硅元素是非金属元素
B.硅元素的元素符号为Si
(2)如图是一种制备高纯硅的工艺流程图:

[查阅资料]常温下,氯化镁溶液呈中性。
①反应I的化学方程式:2Mg+SiO2 Si+2MgO,该反应属于 反应(填基本反应类型)。反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
Si+2MgO,该反应属于 反应(填基本反应类型)。反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
②操作I的名称是过滤,过滤时液面应 (填“高于”或“低于”)滤纸边缘。所得粗硅应充分洗涤,以除去表面可能含有的盐酸、 、(填化学式)。
③简要叙述检验盐酸已过量的方法 。
④上述已知生产流程中,可以循环利用的物质是 (填化学式)。
硅酸钠(Na2SiO3)是我国优先发展的精细化学品,用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)制备硅酸钠(Na2SiO3)的流程如下:

资料:SiO2既不溶于水,也不与盐酸反应。
请回答下列问题:
(1)“研磨”的目的是 。
(2)检验“洗涤a”已洗净的方法是 。
(3)“酸浸”的化学方程式为 。
(4)“碱浸”的化学方程式为 。
(5)“操作a”包含蒸发浓缩、 、过滤、洗涤、干燥等一系列操作。
海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请根据粗盐“制碱”的流程图(如图)回答问题:
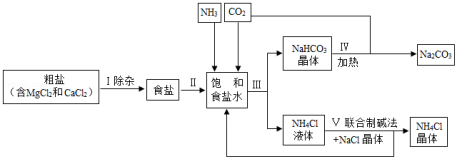
(1)步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的 (填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是 。
A.①Ca(OH)2②Na2CO3
B.①Na2CO3②Ca(OH)2
C.①KOH②Na2CO3
D.①NaOH②Na2CO3
(2)步骤Ⅲ先向饱和食盐水中通入氨气,再通入二氧化碳,这样做的目的是 ,写出步骤Ⅲ反应的化学方程式 。
(3)步骤Ⅳ发生的反应属于 反应(填基本反应类型)。
(4)我国化学家侯德榜创立的联合制碱法的优点有 。
A.无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境
B.大大提高了食盐的利用率,节约了成本
C.将“制碱”与制氨生产联合起来,同时析出的NH4Cl晶体可用作复合肥
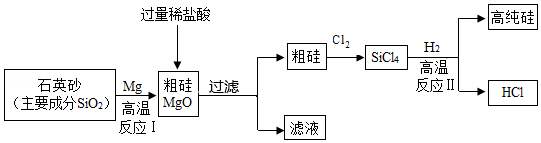
制造芯片的基材主要是高纯硅。如图是制备高纯硅的一种工艺流程:
回答下列问题:
(1)反应Ⅰ的化学方程式是 。
(2)过滤所得粗硅应充分洗涤,以除去表面可能吸附的HCl和 (填化学式)。
(3)反应Ⅱ的基本类型属于 ;反应Ⅱ要在无氧气环境中进行,原因是 (答出一种即可)。
(4)上述生产流程中,可以循环利用的物质是 (填化学式)。