内江拥有中国西南地区最大的再生资源基地,可回收处理大量废旧塑料电器及玻璃等,某品牌电器的废旧电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属) 等金属,如下图是某车间回收部分金属的工艺流程。已知,2Cu+O2+2H2SO4 2CuSO4+2H2O。
2CuSO4+2H2O。
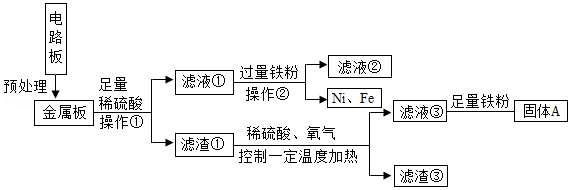
回答下列问题。
(1)操作①中,使用的玻璃仪器除烧杯、玻璃棒外,还需 ;
(2)滤渣③中含有的金属是 ;
(3)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(4)滤液③中加入足量铁粉的主要目的是 ,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为 ;
(5)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是 。
辉铜矿的主要成分为硫化亚铜(Cu2S),工业上用辉铜矿冶铜的一种工艺流程图如下:
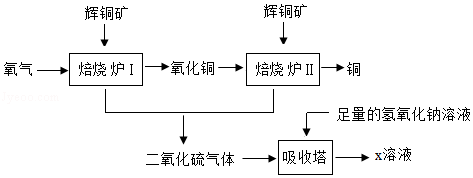
请你回答下列有关问题:
(1)硫化亚铜中铜元素的化合价为 。
(2)焙烧炉Ⅱ中发生反应的化学方程式为 。
(3)二氧化硫与二氧化碳具有相似的化学性质,则x溶液中盐的化学式是 。
如图是某化工企业利用“侯氏制碱法”生产纯碱的部分工艺流程示意图:
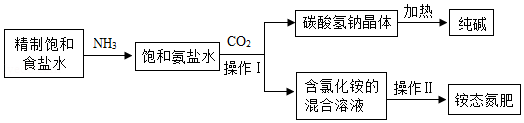
查阅资料知:①NH4Cl NH3↑+HCl↑;②氨气极易溶于水,氨水呈碱性。
(1)检验食盐水是否饱和的方法是 。
(2)操作Ⅰ的名称是 。实验室进行此操作时,玻璃棒的作用是 。
(3)“侯氏制碱法”中,向饱和氨盐水中通入足量的CO2,使氨气、水、NaCl和CO2反应生成NaHCO3等,该反应的化学方程式为 ;先通氨气形成饱和氨盐水,后加压通入二氧化碳,这样操作的目的是 。
(4)处理含氯化铵混合溶液时,不直接加热蒸干得到氯化铵固体的原因是 。
某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:

已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了 现象。步骤①产生的废气B中,一定含有的有害气体是 (填化学式)。环保处理最好釆用的试剂是 (填字母序号)。
A、浓硫酸 B、食盐水 C、石灰乳
(2)写出步骤④中得到铜的化学方程式 ,它属于基本反应类型中的 反应。
(3)步骤③和④中主要操作的名称是 。
(4)我国古代就制得了一种外观似金子的锌和铜的合金,也就是黄铜,它的硬度比纯铜 (填“高”或者“低”)。
(5)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有 (填字母序号)。
A、硫酸镁 B、硫酸锌 C、硫酸铜 D、硫酸铜和硫酸锌
某班同学在实验室完成实验探究后得到废液A,其中含有稀硫酸、硫酸亚铁和硫酸铜。老师将同学们分成甲乙两组,继续进行如下实验,请完成下列相关问题:
[甲组任务]将废液转化成硫酸亚铁晶体。实验流程如图
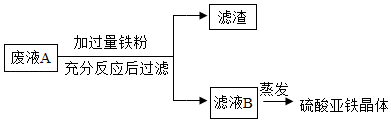
(1)滤液B中的溶质来自于哪几个部分?
(2)写出上述流程中的一个化学反应方程式: 。
[乙组任务]利用废液来探究金属铝的化学性质。实验流程如图: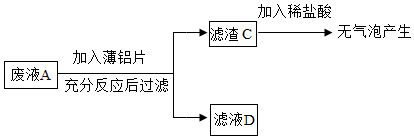
(3)滤渣C中一定没有 。
(4)滤液D中一定含有的溶质是 (填化学式,下同),可能含有的溶质是 。
2020年6月23日,我国长征五号B运载火箭搭载第55颗北斗导航卫星发射成功,北斗三号全球卫星导航系统星座部署全面完成。
Ⅰ.火箭中液氢燃料通过氢泵涡轮高速输送到发动机燃烧室,与液氧混合燃烧产生推动力。该反应的化学方程式为 。
Ⅱ.人造地球卫星的结构材料常用镁合金等,金属镁可从海水中提取,工艺流程如图:
(1)粗盐经过溶解、过滤、蒸发后得到的精盐是 (选填“纯净物”或“混合物”)。
(2)反应②的过程是 (选填“放热”或“吸热”)过程。
(3)“母液”中含MgCl2,以上①~④步化学反应中未涉及的反应类型是 。
a.化合反应
b.分解反应
c.复分解反应
d.置换反应
(4)已知某海域海水中总的含盐量约为3.5%,盐中镁元素的质量分数约为3.7%,则海水中镁元素的质量分数约为 (保留两位有效数字),由此可知,用海水晒盐后剩余的“母液”来提取镁,而不直接用海水的主要原因是 。
汽车给人们的生活带来方便的同时,也带来节能和减排的问题。如图是某种汽车的燃料燃烧过程示意图
(1)从燃烧的条件看,火花塞的作用是 。
(2)将汽油与空气的混合气充分压缩,有助于节省燃料,说明主要原因。
(3)乙醇的含碳量比汽油的低。分析在汽油中加入适量乙醇,对尾气中炭黑排放量的影响。
(4)利用催化净化装置,可使燃烧过程中产生的CO和NO在催化剂的作用下,转化为两种空气中常见的无害气体,该反应的化学方程式为 。
回答下列问题。
(1)从硝酸钾、少量氯化钠和不溶性杂质(泥沙)的混合物中得到硝酸钾的流程如图:
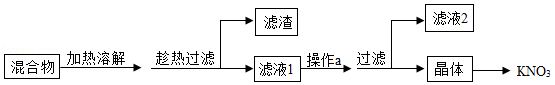
①结合如表分析,趁热过滤的原因是 。
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
|
②操作a的名称是 。
③滤液2的溶质是 。
(2)A~D为初中化学常见物质,A、D为金属,在常温下通过如图所示转化可获取硝酸钾。回答下列问题。
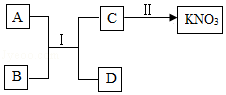
①反应Ⅰ能发生的原因是 。
②若D为银白色贵重金属,则反应i的化学方程式是 ,基本反应类型是 。
③一步实现反应Ⅱ,能否加入氯化钾?判断并说明理由 。
④硝酸钾可作化肥,能供给作物两种养分,属于 肥料。
覆铜板是制作印刷线路板的基本材料。覆铜板中的金属Sn占2﹣10%,Cu占90﹣98%.简易工艺流程如图:
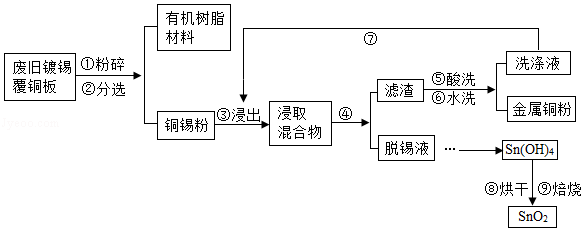
(1)将废旧镀锡覆铜板粉碎后,通过步骤②可将其分离为有机树脂材料(固体)和铜锡粉。根据化学常识回答,此工艺利用的是 的性质(填字母代号)。
a.溶解性不同
b.密度不同
c.沸点不同
(2)步骤④中涉及的分离操作是 (填操作名称)。
(3)通过步骤⑤和⑥所得洗涤液的pH 7(填“>”、“<”、“=”)。
(4)设计步骤⑦的主要目的是 。
(5)步骤⑨中涉及的主要化学方程式为 。
钛(Ti)被称为“航空金属”。由钛铁矿(主要成今是钛酸亚铁,化学式为FeTiO3)制备钛的一种流程如下:

(1)FeTiO3中钛元素的化合价为 。
(2)“氯化”过程中焦炭的作用是 。
(3)由TiCl4制备Ti的化学方程式为 。该反应在氩气(Ar)氛围中进行的理由是 。
(4)如上述流程所示,将钛厂、氯碱厂和甲醇厂组成产业链的好处是 。
利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图(反应条件已略去):
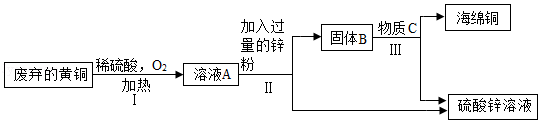
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)过程Ⅱ中加入过量锌粉的目的是 。
(2)过程Ⅲ中有气体产生,所选用的物质C是 (填一种酸)。
教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
Ⅰ.活动探究
(1)学会识图分拣垃圾:下列垃圾应投入带有如图图标的垃圾箱内的是 (填字母序号)。
| A. |
塑料瓶 |
| B. |
果皮 |
| C. |
碎瓷片 |
(2)学会检验有害气体:含氯塑料焚烧时会产生氯化氢等气体。若要检验焚烧后的气体中有氯化氢,可将其通入 溶液中,有白色沉淀生成即可。
Ⅱ.实验探究:
[提出问题]如何回收处理废旧电池中的镉?
[查阅资料]
(1)废旧电池中含有镉、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体。在化合物中通常表现为+2价。
(3)碳酸镉(CdCO 3)、氢氧化镉[Cd(OH) 2]都是白色固体、难溶于水。
[设计实验]先将废旧电池进行处理以制得硫酸镉( CdSO 4)溶液,用于以下实验。
| 实验设计 |
实验步骤 |
实验现象 |
实验结论 |
| 与金属反应 |
取少许溶液于试管中,加入足量的Zn粉,充分反应。 |
|
Zn可以置换出Cd |
| 与碱反应 |
取少许溶液于试管中,加入足量的NaOH溶液,充分反应。 |
产生白色沉淀 |
用化学方程式表示为 。 |
| 与盐反应 |
取少许溶液于试管中,加入足量的 溶液,充分反应。 |
产生白色沉淀 |
可用该试剂除去CdSO 4. |
[回收处理]
实验结束后,将反应后的混合物通过过滤、洗涤、加热,进而再制得镉。
[交流反思]
请同学们基于化学视角说明垃圾分类回收处理的重要意义 (答一点即可)。

自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。①金属镁的物理性质: (写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为 。
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是 ,化学方程式为 。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
苦卤 Mg(OH)2 MgCl2 Mg,流程中X为 。
(4)第四站:再探金属镁。
[提出问题]镁能否与热水反应?如果反应,产物是什么?
[相关信息]①Mg+2H2O=Mg(OH)2+H2↑;②氢氧化镁在热水中能部分溶解。
实验操作 |
实验现象 |
实验结论 |
① ② |
① ② |
镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有 。
海洋中蕴藏着丰富的化学资源,从海水中提取金属镁的主要步骤如图:
资料:海滩贝壳的主要成分是CaCO 3

(1)为节约资源,试剂X常用海滩贝壳为原料制得,则试剂X为 (填化学式);
(2)操作Y的名称为 ;
(3)在熔融状态下的MgCl 2,通电后会生成镁与一种气体单质,该反应的化学方程式为 。
(4)镁常用作合金,一般地合金相对于纯金属,具有的优良特性有 (填序号)。
A.硬度小
B.熔点高
C.抗腐蚀性强
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
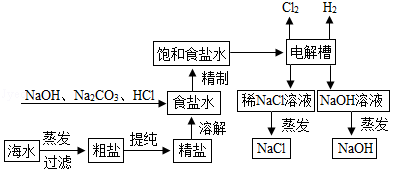
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
①你认为碱样品中含有Na2CO3的原因是 ,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)