某兴趣小组在实验室模拟水厂将浑浊的湘江水净化成自来水,并最终制成蒸馏水,其实验流程如图所示:

请回答下列问题:
(1)加入明矾的作用是 ;操作1的名称是 。
(2)利用如图所示的装置进行操作2,此操作的作用是 待处理的水应该从 端通入(填"a"或"b"),理由是 。

(3)取少量的液体D于试管中,滴入肥皂水振荡,发现有较多的浮渣产生,说明此液体为 (填"软水"或"硬水"),生活中常用 的方法软化硬水。
(4)通过操作3可以得到净化程度较高的蒸馏水,操作3的名称是 。
工业上用闪锌矿(主要含ZnS,还有PbS等杂质)制备Zn,并将产生的废气转换成工业原料,设计流程如图(部分产物略去)。

(1)X的化学式 ,图中用过量空气的目的是 ;
(2)①~ ④中属于化合反应的是 ;
(3)Zn (填“能”或“不能”)与氯化铅(PbCl2)溶液反应;
(4)写出③中生成ZnO的化学方程式 ,产生的工业废气SO2在一定条件下与氧气化合生成的Z物质是 (填化学式)。
工业上生产纯碱的部分工艺如下:

反应原理是①NaCl+H2O+NH3+CO2═NH4Cl+NaHCO3↓
②2NaHCO3 Na2CO3+H2O+CO2↑
某兴趣小组设计了如下装置在实验室模拟该制碱过程,分析并回答问题。

(1)装置C中发生反应的化学方程式是 。
(2)B中导气管的作用是 。
(3)反应原理②的实验可在 (填字母)装置中进行。
(4)反应过程中的副产品NH4Cl是农业上常用的 (填肥料种类)。
据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd(钯,银白色)。如图是某工厂回收其中部分金属的流程图。(假设流程图中各反应均恰好完全反应。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
2CuSO4+2H2O)
(1)步骤②中产生的气体是 。
(2)滤渣2中含有的金属是 。
(3)步骤⑤反应的化学方程式 。
(4)步骤⑥回收的纯净物B是 (写化学式)。
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是 。

氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示:

参考资料:SiO2既不溶于水也不与酸反应
(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为 ;
(2)残渣中除金属锌外,还有 ;
(3)操作一、操作二和操作三采用的分离方法是 ;
(4)操作四发生反应的化学方程式为 。
海洋中蕴含丰富的资源。
(1)海水淡化是解决淡水资源不足的重要方法,下列方法中,可以使海水淡化的是 (填字母序号);
A.滤纸过滤 B.吸附 C.沉降 D.蒸馏
(2)从海水中提炼出来的重水(D2O)可作原子能反应堆中的减速剂和传热介质,重水中重氢原子(D)的相对原子质量是2,则重水中氧元素的质量分数为 ;
(3)利用海水制取纯碱和金属镁的流程如图所示,试回答问题:

①1925年我国化学家 创立了联合制碱法,促进了世界制碱技术的发展,其第Ⅲ步反应的化学方程式为 ;
②步骤Ⅴ中所加试剂是 。
目前,农业上使用最多的氮肥主要有尿素、硝酸铵和碳酸氢铵等,其中硝酸铵的生产原理是利用氨催化氧化得到的硝酸,再跟氨反应生产硝酸铵,基本流程如下:

已知:①上述流程图中A、B、C均为气体,其中A、B为单质且A的相对分子质量为28,C为含有A组成元素的化合物;氨与氧气反应的条件是高温、催化剂。
②在化学反应中,只要有物质所含元素的化合价发生了变化的反应就是氧化还原反应。例如:2Na+2H 2O═2NaOH+H 2↑,反应前后,Na元素、H元素的化合价分别发生了变化,该反应是氧化还原反应。
请回答下列问题:
(1)写出A、C两种物质的化学式:A为 ;C为 。
(2)NH 3和O 2反应的化学方程式为
(3)上述流程图的5个反应中有 个属于氧化还原反应。
为了将混有硫酸钾、氯化钙、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钾提纯,并制得纯净的氯化钾溶液,某同学设计的实验流程如下

请根据以上流程图中的信息.回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是 ;
(2)步骤④中加过量碳酸钾溶液的目的是 ;
(3)此设计方案是否严谨?并说明理由 .
我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:

【小资料】
I、贝壳的主要成分是CaCO3
Ⅱ、通常情况下,1体积水中大约能溶解700体积氨气,1体积水中大约能溶解1体积二氧化碳
Ⅲ、饱和食盐水中发生的主要反应为:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(1)合成氨需要的氮气来自空气,空气属于 (填“混合物”或“纯净物”)。空气中氮气的体积分数约为 。
(2)过程②中主要操作的名称是 。
(3)过程①中发生反应的化学方程式为 ,过程③中反应所属基本反应类型为 。
(4)为了提高产率,往饱和食盐水中通入气体时,你认为应该先通入 (填“NH3”或“CO2”),你的理由是: 。
(5)上述流程中可以循环利用的物质是: (填化学式)
海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛.
2+2+42﹣22323溶液的目的是 .
(2)利用苦卤制取镁,主要流程如图:

步骤Ⅱ中的试剂a是 .步骤Ⅰ中反应的化学方程式是 .
(3)采用氨碱法生产纯碱,主要流程如图:

①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是 .
②从步骤Ⅱ过滤后的滤液中可获得铵态氮肥.检验铵态氮肥的方法是 .
海水中有着丰富的化学资源,人们可以从海水中提取出很多的物质,如:氯化钠、镁等.如图就是利用海水提取氯化钠的大致过程:

(1)图中①是 (填“蒸发池”或“冷却池”);
(2)析出晶体后的母液是氯化钠的 (填“饱和溶液”或“不饱和溶液”);
(3)实验室除去粗盐中难溶性杂质的主要实验步骤有:
Ⅰ溶解Ⅱ (填操作名称)Ⅲ蒸发
(4)提取粗盐后的母液中含有较多氯化镁,从母液中提取金属镁的过程大致如下:

该过程中反应Ⅰ的基本反应类型是 ;
写出反应Ⅱ的化学方程式为 .
某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:

已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣Ⅰ中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 ,此反应属 (填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 。
氨气(NH 3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH 4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.
(1)下列装置是实验室制取气体的一些发生装置,a仪器为 ,b仪器为 .制取二氧化碳的发生装置是 (填字母序号);制取氨气的发生装置是 (填字母序号),收集氨气的方法是 .
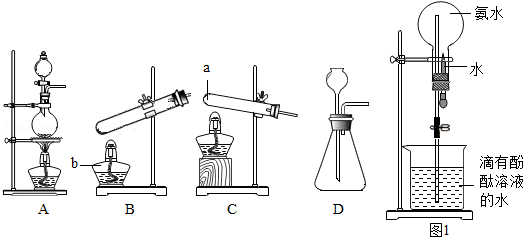
(2)图1是氨气的喷泉实验装置.打开橡皮管上的夹子,将胶头滴管中的水挤入盛满干燥氨气的烧瓶中,因为氨气极易溶于水,烧瓶内的压强降低,烧杯中的水就会进入烧瓶,形成 色的喷泉.
(3)当喷泉实验结束后,测烧瓶内溶液的pH.
步骤如下:
步骤一:用手撕一小段pH试纸,放到干净的玻璃片上.
步骤二:用蒸馏水润湿pH试纸.
步骤三:用玻璃棒蘸取待测液滴到pH试纸上.
步骤四:把试纸显示的颜色与标准比色卡对比,读取pH.
该实验步骤有几处错误? 处,请改正: .
某工厂产生的废水中含有硫酸锌和少量的硫酸铜以及污泥,为了变废为宝,利用废水制取七水硫酸锌( ZnSO 4•7H 2O),其工艺流程图如下:

回答下列问题:
(1)步骤①的操作名称 .
(2)步骤②需如入过量的物质是 ,目的是 .
(3)步骤③需加入的溶液是 .
(4)步骤④的操作是蒸发浓缩, ,过滤.
(5)如果用ZnSO 4•7H 2O来配制100g 32.2%的硫酸锌溶液,需要 g七水硫酸锌.
日常生活中使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所填充,其结构如图1所示。某学校化学兴趣小组的同学准备从废旧的干电池中分离出二氧化锰,并制备硫酸锌固体。
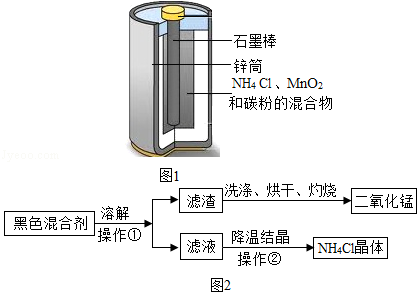
Ⅰ:设计回收二氧化锰的流程如图2所示:
(1)操作①和操作②的名称都是 ,该操作中玻璃棒的作用是 。
(2)上述操作中灼烧滤渣的目的是 。
(3)为了有效回收、利用二氧化锰,小茗同学用回收的二氧化锰与双氧水来制取氧气,请你写出该反应的化学方程式 。
Ⅱ:制备硫酸锌固体的实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应
②将滤液加热浓缩,得到热的饱和溶液
③将上述反应后的混合物过滤
④降温结晶
⑤过滤,得到ZnSO 4•7H 2O晶体
(1)正确的实验操作顺序为(填序号) 。
(2)步骤①中反应的化学方程式 。
Ⅲ:废旧干电池随意丢弃会造成环境污染。请你指出对废旧干电池的处理意见(只填一条): 。