甲、乙、丙、丁都是含碳的物质,它们有如下关系:①甲与丙在高温的条件下反应生成乙;②乙与氧气在点燃的条件下反应生成丙;③常温下丁能分解生成丙。则甲、乙、丙、丁分别是( )
A.C、CO、CO2、CaCO3B.C、CO、CO2、H2CO3
C.CO、C、CO2、CaCO3D.CO2、C、CO、H2CO3
海洋是人类宝贵的自然资源,海水“制盐”体现了人类利用化学科学征服和改造自然的智慧。通过晾晒海水,可以得到粗盐,粗盐中含有不溶性杂质(如泥沙等)和可溶性杂质(如MgCl2、CaC12等),工业上以粗盐为原料制取精盐,其生产流程如图所示
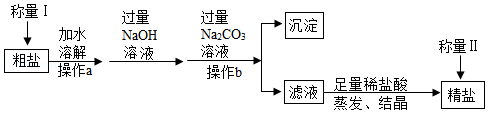
请回答下列问题:
(1)操作b中玻璃棒的作用是 。
(2)加入Na2CO3溶液除去的离子是 (填离子符号),加入NaOH溶液发生反应的化学方程式为 ;
(3)滤液中溶质的主要成分是 (填化学式),加入足量稀盐酸的目的是 。
(4)如果称量Ⅰ中称得粗盐的质量为3g,称量Ⅱ中称得精盐的质量为3.1g,则下列分析正确的是 (填字母)
A.精盐的产率为103.3%
B.蒸发操作中可能有水分没有蒸干
C.除杂过程中有NaCl生成
D.溶解操作中粗盐没有完全溶解
自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。①金属镁的物理性质: (写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为 。
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是 ,化学方程式为 。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
苦卤 Mg(OH)2 MgCl2 Mg,流程中X为 。
(4)第四站:再探金属镁。
[提出问题]镁能否与热水反应?如果反应,产物是什么?
[相关信息]①Mg+2H2O=Mg(OH)2+H2↑;②氢氧化镁在热水中能部分溶解。
实验操作 |
实验现象 |
实验结论 |
① ② |
① ② |
镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有 。
芯片是中美经贸摩擦的焦点之一。制造芯片的高纯硅可以用下述方法制取(反应条件略):
下列有关说法错误的是( )
A.反应①、③均为置换反应
B.SiCl4中Si的化合价为+4
C.Si 在化学变化中易得电子
D.硅原子的核电荷数为14
2020年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。从废线路板中提炼贵重金属和制备硫酸铜晶体的一种工艺流程如图:

已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
(1)操作①的名称是 ;
(2)提炼出的贵重金属可制作奖牌,其成分是 ;
(3)调节pH的主要目的是除去滤液中 (填金属离子符号);
(4)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式: 。
分子筛(又称为沸石,主要成分为水和硅铝酸钠)可作为催化剂或吸附剂等,以高岭土[主要成分为Al2(Si2O5](OH)4].烧碱等为主要原料生产分子筛的工艺流程如图:

(1)步骤①所得烧渣中主要含有两种固体氧化物,分别为SiO2和 (写化学式)
(2)步骤②加入NaOH溶液前需将烧渣粉碎,其目的是 。
(3)步骤③发生的反应之一是Na2SiO3溶液和通入的CO2气体生成偏硅酸(H2SiO3)沉淀和碳酸氢钠,该反应的化学方程式为 。
(4)上述流程中可以循环利用的物质(水除外)是 。
海水中镁元素的总储量约为2.1×10 15t,可用于生产金属镁,目前世界生产的镁60%来自海水。利川用海水提取镁的工业流程如图所示。下列说法错误的是( )
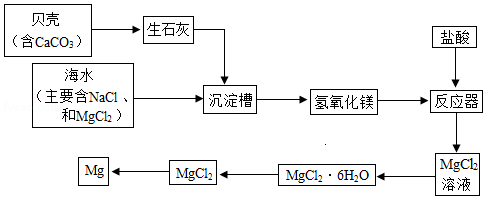
| A. |
沉淀槽中总的化学方程式为:MgCl 2+CaO+H 2O═Mg(OH) 2↓+CaCl 2 |
| B. |
在上述流程中,元素的化合价均没有发生变化 |
| C. |
反应器中发生的化学反应类型为中和反应 |
| D. |
由贝壳制取生石灰的反应条件是高温 |
我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板.原理是:发电过程中产生的烟气中含有大量的SO 2,热电厂用"碱﹣石灰﹣石膏(CaSO 4•2H 2O)"的方法使烟气脱硫从而生成石膏.

(1)工业烟气没经处理直接排放到空气中易形成 ,会污染、破坏环境;
(2)写出吸收塔内发生反应的化学方程式 ;工业上用分离液态空气法制氧气,是利用空气中各成分的 不同进行分离的;
(3)化学反应类型有不同的分法,其中反应前后,有元素化合价变化的化学反应是氧化还原反应.有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂.化学反应前后元素化合价没有变化的化学反应是非氧化还原反应.则下列说法正确的是
A、吸收塔、制碱釜中发生反应属于氧化还原反应
B、制碱釜中的反应物Na 2SO 3作氧化剂
C、氧化塔中发生的反应属于氧化还原反应
D、氧化塔中的反应物CaSO 3作还原剂
(4)生产流程中生成的 可循环利用,节约成本.
海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛.
(1)为了除去粗盐溶液中的Ca 2+、Mg 2+、SO 4 2﹣,可按照下列实验步骤进行:①加过量BaCl 2溶液②加过量NaOH溶液③加过量Na 2CO 3溶液④过滤⑤加入适量盐酸.其中步骤③加过量Na 2CO 3溶液的目的是 .
(2)利用苦卤制取镁,主要流程如图:

步骤Ⅱ中的试剂a是 .步骤Ⅰ中反应的化学方程式是 .
(3)采用氨碱法生产纯碱,主要流程如图:

①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是 .
②从步骤Ⅱ过滤后的滤液中可获得铵态氮肥.检验铵态氮肥的方法是 .
碳酸亚铁(FeCO3)可用于制作补铁药物,以下是用硫铁矿烧渣(主要成分为Fe2O3、SiO2等)为原料制备碳酸亚铁的生产流程示意图:
【资料】40℃以上时,(NH4)2CO3易分解。

(1)操作Ⅰ的名称为 。
(2)写出向固体A中加入稀硫酸后发生的化学方程式: 。
(3)加入(NH4)2CO3后,该反应必须控制的条件是 。
(4)从溶液C中可回收一种化工产品,请写出它的一种用途 。
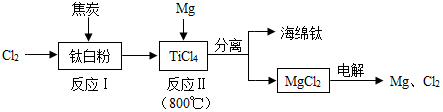
21世纪是钛的世纪,利用钛白粉(TiO2)生产海绵钛(Ti)的工艺流程如图所示。下列叙述不正确的是( )
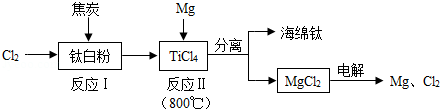
A.反应I除生成TiCl4以外,还生成一种可燃性气体,该气体应该是CO
B.反应II的原理是TiCl4+2Mg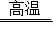 Ti+2MgCl2
Ti+2MgCl2
C.反应II需在氩气环境中进行,目的是防止镁被氧化,不能用氮气来代替氩气
D.该工艺流程中可以循环使用的物质为氯气
21世纪是钛的世纪,利用钛白粉(TiO2)生产海绵钛(Ti)的工艺流程如图所示。下列叙述不正确的是( )
A.反应I除生成TiCl4以外,还生成一种可燃性气体,该气体应该是CO
B.反应II的原理是TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
C.反应II需在氩气环境中进行,目的是防止镁被氧化,不能用氮气来代替氩气
D.该工艺流程中可以循环使用的物质为氯气
氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
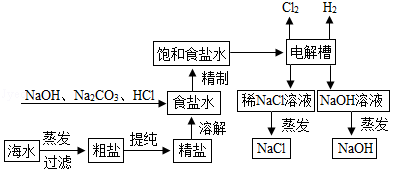
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
①你认为碱样品中含有Na2CO3的原因是 ,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
在给定条件下,下列物质间的转化能实现的是( )
| A. |
CaCO 3→CaO |
B. |
KMnO 4 |
| C. |
Fe |
D. |
Fe |
硫酸亚锡(SnSO4)广泛应用于电镀工业。该物质易与氧气反应而变质。实验室模拟工业上制取SnSO4的一种实验方案如下:

(1)SnCl2由Sn与盐酸反应制得,同时生成氢气,该反应的化学方程式为 ↑ 。
(2)Na2CO3俗称 。
(3)过滤所得滤液中的溶质为 (填化学式)。
(4)用已知质量分数和密度的浓硫酸配制质量分数为15%的稀硫酸,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和 。稀释浓硫酸的正确操作为 。
(5)反应2属于基本反应类型中的 反应。从反应2所得溶液中获得SnSO4晶体的部分操作须在隔绝空气条件下进行的原因是 。