某兴趣小组做了如下实验.
【实验一】提纯NaCl
请根据实验回答下列问题:
(1)操作①、②、③依次为下图中的(填序号) .
(2)若得到NaCl的产率比实际值偏低,则可能的原因是(填序号) .
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.把晶体从蒸发皿转移到天平上称量时,有少量粘在了蒸发皿上
D.溶解11g含有泥沙的NaCl时,加入的水量不足
(3)用上述实验所得的氯化钠配制溶质质量分数为5%的氯化钠溶液50g,不需要的仪器为(填序号) .
A.量筒 B.天平 C.烧杯 D.漏斗 E.蒸发皿 F.玻璃棒 G.酒精灯
【实验二】溶解和结晶KNO3
请根据实验和KNO3溶解度曲线回答下列问题(水的密度以1g/mL计):
| 实验操作 |
实验结果 |
| 取100mL水,加入25gKNO3,搅拌,20℃ |
全部溶解,得溶液① |
| 再加Xg KNO3,搅拌,20℃ |
恰好饱和,得溶液② |
| 再加25g KNO3,搅拌,20℃ |
得溶液③ |
| 加热 |
全部溶解,得溶液④ |
| 冷却至20℃ |
晶体析出,得溶液⑤ |
(4)溶液③的质量为 ;一定属于不饱和溶液的是(填数字序号) ;溶质的质量分数一定相等的是(填序号) .
(5)析出晶体的质量为(填序号) .
A.25g B.X+25g C.X+100g.
右图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。
(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么,50g水中溶解 g乙,溶液达到饱和;
(2)t2℃时,比较两物质的溶解度大小: ;
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是
(写出一种即可);
(4)若要从甲中含有少量乙的混合溶液
中提纯甲,可用的方法是 。
实验室配制100g 10%的氯化钠溶液,请按要求回答问题。
(1)量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是图中的__ __ (填字母)。 
(2)下列仪器中,量取水时需要用到d和____仪器,溶解时需要用到e和___仪器。
a.烧杯 b.10mL量筒 c.100mL量筒 d.滴管 e.玻璃棒 f.药匙 g.蒸发皿
(3)在粗盐提纯中,将氯化钠溶液蒸发至有较多量固体析出后,应 ,并用玻棒不断搅拌,利用余热将余下溶液蒸发至干。
(4)实验室中配好的溶液,应贴上标签密封放到试剂柜中保存。一定溶质质量分数的氯化钠溶液须密封保存的原因是________。
水和以水为溶剂制成的溶液,与人们的生活有着密切的关系。
(1)生理盐水中的溶剂是 。
(2)市售的一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,饮料温度就会降低,这种固体物质可能是 (填字母)。
| A.烧碱 | B.食盐 | C.硝酸铵 | D.生石灰 |
(3)下图为a、b两种固体物质的溶解度曲线,请依据曲线图回答问题:
①在t3℃时,50g水中最多能够溶解a物质的质量是 ;
②在 ℃时,a物质的饱和溶液和b物质的饱和溶液中,溶质的质量分数相等。
③把100g质量分数为20%的a溶液从t3℃降温到t2℃,此时a溶液的质量分数是 。
(4)现有一瓶浓硫酸,标签如图所示。欲将该瓶浓硫酸完全稀释成20%的稀硫酸,需要水的质量是 g。 
溶液在生产和科研中具有广泛的用途。请回答下列问题:
(1)每年5月12日为全国“防灾减灾日”。家庭准备云南白药、碘酒、红药水、双氧水、高锰酸钾等杀菌消毒、止血、防感染的药品,是很好的预防措施。
①碘酒的溶剂为 ,双氧水中的溶质为(填化学式) 。
②高锰酸钾由(填数字) 种元素组成。
(2)在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐。这里的碱指的是Na2CO3,盐指NaCl,两种物质的溶解度曲线如右图表示。
①10 ℃时,100 g水中最多溶解碳酸钠 g。 ②40 ℃时,碳酸钠的溶解度(填字母序号) 氯化钠的溶解度。
a.大于 b.等于 c.小于
③请根据两种物质的溶解度曲线图说明我国青海湖地区冬天捞碱的原因为 。
甲、乙、丙三种固体物质的溶解度曲线如下图所示。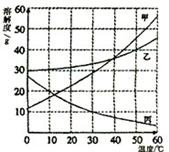
(1)30℃时,丙的溶解度是___________。
(2)20℃时,甲、乙、丙三种物质的溶解度按由大到小的顺序排列的是 。
(3)欲将20℃时丙不饱和溶液变为饱和溶液,可采用的方法是 (写出一种即可)。
(4)5℃时,取甲、乙、丙三种固体物质各20g分别加入盛有100g水的烧杯中,充分搅拌后得到的溶液,能够饱和的是_________________物质的溶液。又将三个烧杯中的混合物温度都升高到30℃,所得溶液溶质质量分数的大小关系是_______________。
(5)现要配制20℃时70g10%的甲溶液。该实验的部分操作如下图所示。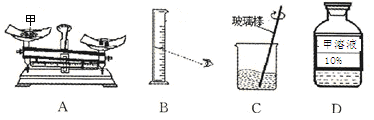
①需要称取甲的质量是________________,称量时图A出现了右盘低的现象,接下来的操作应该是____________________。
| A.左边的平衡螺丝向左调 | B.将游码向左移动 |
| C.右盘中减少砝码 | D.左盘中增加甲 |
②量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_______________(填“偏大”或“偏小”)。
③图C中用玻璃棒搅拌的作用是________________________。
下图为A、B、C三种物质的溶解度曲线,请回答。
(1)M点表示的意义是 。
(2)t10C时,三种物质的溶解度由小到大依次为 ;t30C时,溶解度最大的是 。
(3)若把混在A中的少量C除去,应采用 方法;
(4)由t30C降至t10C时,三种物质中析出晶体最多的是 ;
(5)若把10g20%的A溶液稀释到10%,需加水的质量为 g;(计算写过程,以下相同)
水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)"生命吸管"(如右图)是一种可以随身携带的小型水净化器,里面装有网丝、注入了活性炭和碘的树脂等。其中活性炭起到和过滤的作用。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为。
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为g。
(4)根据下表回答问题。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 /g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
| NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.6 |
77.3 |
①60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是溶液。
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法正确的是(填字母序号)。
A.溶质的质量不变
B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变
D.可升高温度或增加溶剂