硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如下图所示:
⑴ 硫铁矿烧渣是 物(填“纯净”或“混合”)。
⑵请写出反应炉中CO与Fe3O4反应的化学方程式 ;
⑶ 溶液D中的溶质主要是 (填化学式);
⑷ 实验室完成操作①,用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称)
⑸ 气体C的主要成分是 ; 你认为对气体C最佳的处理方法是 。
A.冷却后排入空气 B.燃烧后排放 C.再通入反应炉
⑹ 为了检验FeCO3固体是否洗涤干净,可以向最后的洗出液中加入
A.硝酸钾溶液 B.氯化钡溶液 C.氯化钠溶液
⑺ 在空气中煅烧FeCO3生成Fe2O3与CO2,该反应的化学反应方程式为 。
(6分)某化学实验小组用一块表面镀锌的铁样品进行实验探究活动。
【实验探究】将表面镀锌的铁进行如图A实验,加入稀盐酸与产生氢气的质量关系如图B。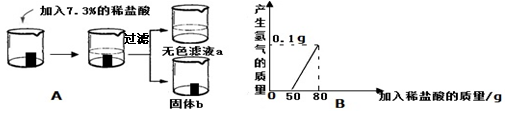
【提出问题】反应后所得的无色滤液a的溶质与固体b的成分是什么?
【猜想假设】秦思认为无色滤液a的溶质是(1) 、氯化亚铁和氯化氢。
【反思评价】请你评价秦思的猜想(2) 。
【推理判断】由无色滤液a 的成分可推知,固体b中一定含有(3) 。
【实验与结论】为验证固体b的成分,单杰向b的样品中加入一种有色物质(4) (填化学式)溶液,产生的现象是(5) ,据此现象,证明出固体b中的两种成分,同时得出这两种金属的活动性顺序。
【表达交流】石建向固体b中继续滴加少量稀盐酸也确定出固体b的成分,他观察到的现象是
(6) 。
【拓展延伸】通过比较锌、铁的活动性,结合图像B在开始加入稀盐酸的过程中并没有产生氢气的现象,你认为在铁的表面镀锌的原因是(7) ,可阻止进一步氧化。
物质在“潮湿的空气”中发生的变化,主要与空气中某些气体有关,下列说法不正确的是
| A.钢铁生锈与氧气、水蒸气有关 |
| B.生石灰堆放久了变质与氧气、水蒸气有关 |
| C.铜器表面生成铜绿与氧气、二氧化碳、水蒸气有关 |
| D.氢氧化钠固体潮解、变质与水蒸气、二氧化碳有关 |
常温下甲酸(HCOOH)是一种无色、有刺激性气味的液体,与浓硫酸混合加热的反应为:HCOOH CO↑+H2O。实验室可利用下图装置制取CO并还原CuO。下列说法不正确的是
CO↑+H2O。实验室可利用下图装置制取CO并还原CuO。下列说法不正确的是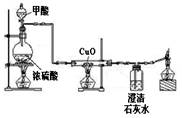
| A.甲酸生成CO的反应属于分解反应 |
| B.实验中应先加热CuO,后通入CO气体 |
| C.硬质玻璃管中的实验现象是黑色固体变为红色固体 |
| D.硬质玻璃管和其中固体的总质量反应后减小 |
在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
【实验目的】铁生锈条件的探究。
【实验内容】取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
实验① 实验② 实验③
【实验现象】实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。
【实验结论】铁生锈实际上是铁与空气中的 (填名称)发生反应的结果。
【实验思考】
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的 。
(2)该实验创新之处在于:可根据铁丝表面的铁锈和 两种现象来判断铁丝反应进行的情况。
(3)铝比铁活泼,但铝难腐蚀,原因是 。
(4)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什么合理的建议 。(答一点即可)
铁生锈探秘
为探究铁生锈的原因,化学兴趣小组的同学进行了如图所示的四个实验:
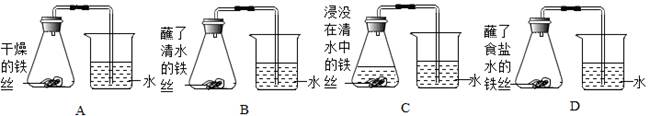
实验结果显示:B、D实验中铁生了锈,而A、C实验中没有明显的现象,仔细分析这4 个实验,回答下列问题:
(1)评价方案
对照实验指除了一个变量外,其他的量都保持不变的实验.该实验方案中采用了对照实验方法.请指出其中的对照实验(填ABCD实验代号)和变量.
第①组对照实验,变量.
第②组对照实验,变量.
第③组对照实验,变量.
(2)解释数据
实验时,每隔一段时间测量导管内水面上升的高度,结果如下表所示(表中所列数据为导管中水面上升的高度/cm ):
| 时间/小时 编号 |
0 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
| A |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| B |
0 |
0 |
0 |
0.3 |
0.8 |
2.0 |
3.5 |
| C |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| D |
0 |
0.4 |
1.2 |
3.4 |
7.6 |
9.5 |
9.8 |
导致B、D实验装置中导管内水面上升的原因是.
(3)获得结论
根据本实验,你认为导致铁生锈的物质有;能加快铁生锈的物质是.
下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是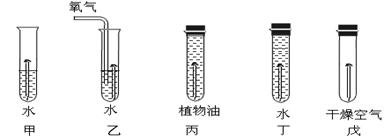
| A.甲、乙中铁钉生锈快慢的顺序为:乙>甲 | B.丙和戊中的铁钉都不生锈 |
| C.铁生锈的主要条件是与氧气、水直接接触 | D.丁中铁钉生锈最严重 |
钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
Ⅰ.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能 ;
(2)某钢铁厂每天消耗5000t含氧化铁80%的赤铁矿石,该厂理论上可日产含铁98%的
生铁的质量是多少?
Ⅱ.实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:
①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4  CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;
于是他设计了下图的实验装置,结合装置回答下列问题:
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的 (填装置编号);
(2)图中装置C、D的作用分别是 、 ;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的澄清石灰水,该反应的化学方程式为 ;
(4)该装置设计有一个明显缺陷,你认为是 。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑
后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现
固体全部溶解,但无气泡产生。
查阅资料:a. 铁的氧化物在足量的稀盐酸中均能全部溶解。
b. Fe2O3与CO反应的固体生成物可能情况如下: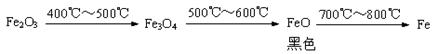
根据“无气泡”猜想,黑色粉末可能是:①Fe3O4;② ③ 。
(6)定量分析 用电子天平称量得部分数据如下:
| |
玻璃管质量] |
玻璃管及其中固体的质量 |
装置F及其中物质的总质量 |
| 反应前 |
28.20 g |
33.00 g] |
300.0 g |
| 反应后 |
32.84 g |
300.4 g |
根据上述数据,请选择有效的数据,推断出反应后黑色固体的成分。(写出计算过程) 。
右图是关于铁的化学性质的知识网络图(箭头表示转化方向,部分反应物、生成物省略),其中B是可燃性气体单质,C为红色金属,D是疏松多孔的红色物质---铁锈。请回答下列问题: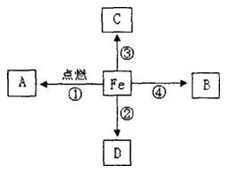
(1)反应①在盛有氧气的集气瓶里发生时,现象是________;A的化学式为________。
(2)D物质为铁锈,其主要成分的化学式为________________。
(3)写出反应③的化学方程式________________________。
(4)写出B在空气中燃烧的化学方程式________________。
下列铁制品的防锈方法不合理的是
| A.公交车扶手—涂防锈油 | B.水龙头—镀防护金属 |
| C.汽车外壳—烧漆 | D.脸盆—烧涂搪瓷 |
某化学小组对铁的冶炼、铁的锈蚀与防护进行以下实验探究.
(1)该小组设计如图1研究铁的冶炼.
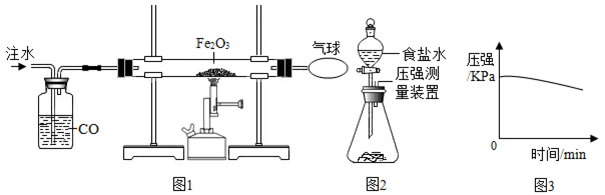
①实验时,应先注水片刻后再加热的目的是 .
②硬质玻璃管中发生反应的化学方程式是 .
(2)该小组又设计如图2装置,将反应所得铁粉置于锥形瓶底部,塞紧瓶塞,滴加适量食盐水,开始 测量容器内压强的变化.压强与时间变化关系如图3所示:
①实验中食盐的作用是 .
②锥形瓶内压强下降的原因是 .
③生产、生活中铁制品的常见防锈方法有 (举一例).
某化学兴趣小组进行铁生锈的实验探究活动。

[探究一]铁生锈的条件
(1)该兴趣小组将洁净无锈的铁钉分别置于上图所示装置中,经过一段时间观察,(填装置序号)装置中出现了明显的锈迹。
他们的结论:铁生锈是因为铁与空气中的等发生了化学反应。
(2)甲同学提出了疑问:空气中的氮气、二氧化碳没有参与铁的生锈过程吗?请设计实验为甲同学释疑。,观察并记录现象即可证明。
[探究二]影响铁生锈速率快慢的因素
乙同学说:妈妈常说菜刀沾有盐水生锈更快。这种说法对吗?同学广泛查阅资料。
资料一:导电性强的溶液都可加速铁的生锈。
资料二:海上航行的轮船在与海水接触的部分镶嵌一锌块,能有效降低钢材被腐蚀的速率。
(3)将上述
装置中的蒸馏水改为下列液体中的,可使铁生锈的速率加快。
| A. |
硫酸钠溶液 |
B. |
无水乙醇 |
C. |
蔗糖溶液 |
(4)一些铁制品表面覆盖了某些涂层。不同的涂层被破坏后,铁生锈的速率不同。你认为下列涂层破坏后,铁生锈的速率较快。
| A. |
镀锌铁 |
B. |
镀锡铁 |
(5)一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是。
| A. |
银粉 |
B. |
铜粉 |
C. |
镁粉 |
[交流与思考]
(6)写出一种防止铁生锈的方法。
钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能 ;
(2)某钢铁厂每天消耗5000t含氧化铁80%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?
II.实验探究炼铁原理某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 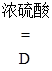 CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的 (填装置编号);
(2)图中装置C、D的作用分别是 、 ;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的澄清石灰水,该反应的化学方程式为 ;
(4)该装置设计有一个明显缺陷,你认为是 。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a.铁的氧化物在足量的稀盐酸中均能全部溶解。
b.Fe2O3与CO反应的固体生成物可能情况如下:
根据“无气泡”猜想,黑色粉末可能是:①Fe3O4;② ③ 。
(6)定量分析 用电子天平称量得部分数据如下:
| |
玻璃管质 |
玻璃管及其中固体的质量 |
装置F及其中物质的总质量 |
| 反应前 |
28.20 g |
33.00 g |
300.0 g |
| 反应后 |
32.84 g |
300.4 g |
根据上述数据,请选择有效的数据,推断出反应后黑色固体的成分。(写出计算过程)
A、B、C、D、E、X、Y、Z都是初中化学中的常见物质,其中A是天然气的主要成分,X、Y、Z是单质,B、C、D、E是氧化物,常温下C是液体,Y是黑色固体,E是红棕色粉末。它们之间有如下反应关系: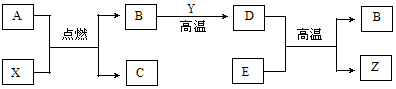
请根据以上信息回答下列问题:
(1)有关物质的化学式:A为 ,C为 。
(2)B与Y反应的化学方程式为 ,
D与E反应的化学方程式为 。