氢氧化钠和碳酸钠的溶解度如表所示。
表:氢氧化钠和碳酸钠溶解度
| 溶剂 |
氢氧化钠 |
碳酸钠 |
|
|
| 20℃ |
40℃ |
20℃ |
40℃ |
|
| 水 |
109g |
129g |
21.8g |
49g |
| 酒精 |
17.3g |
40g |
难溶 |
难溶 |
下列有关分析和推理不正确的是( )
| A. |
氢氧化钠易溶于水和酒精 |
| B. |
温度相同,同种物质在不同溶剂中溶解度不同 |
| C. |
40℃碳酸钠饱和水溶液溶质质量分数为49% |
| D. |
20℃时,将足量二氧化碳通入饱和氢氧化钠酒精溶液中,溶液变浑浊 |
如图是甲乙两种物质的溶解度曲线。下列说法正确的是( )

A.甲的溶解度比乙的溶解度大
B.a2℃时,将30g甲放入50g水中充分搅拌可得80g溶液
C.a1℃时甲、乙两种物质的饱和溶液溶质的质量分数相同
D.将a1℃时甲、乙同种物质的饱和溶液升温至a2℃,溶质的质量分数都增大
如图是甲、乙、丙三种固体物质在水中的溶解度曲线。下列说法正确的是( )
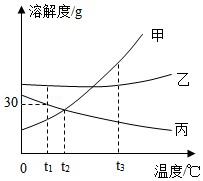
A.t1℃时丙的饱和溶液升温到t3℃变为不饱和溶液
B.t2℃时,甲、丙两种物质的溶解度相等
C.甲中混有少量的乙,可采用蒸发结晶的方法提纯甲
D.t1℃时将20克丙物质溶于50克水中,得到70克溶液
某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )
A.变大 不变B.变大 变小C.不变 变大D.不变 不变
某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )
A.变大 不变B.变大 变小C.不变 变大D.不变 不变
小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
| 序号 |
温度/℃ |
水的质量/克 |
加入硝酸钾的质量/克 |
所得溶液的质量/克 |
| ① |
10 |
100 |
40 |
120.9 |
| ② |
60 |
100 |
40 |
140 |
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
硝石是主要含KNO3的天然矿物,历史上《本草经集注》中对硝石有记载:“强烧之,紫青烟起……云是真硝石也”。下列有关KNO3的叙述不正确的是( )
A.是一种化合物
B.可用作复合肥料
C.可能发生分解反应
D.其溶解度一定大于NaCl的溶解度
X、Y、Z三种物质的溶解度曲线如图所示,下列说法正确的是( )

A.Y的溶解度为50g
B.T2℃时,X、Y两种物质溶解度相等
C.T1℃时,三种物质的溶解度由大到小的顺序是Y>X>Z
D.T2℃时,50g H2O与50g X混合,可得到100g X的饱和溶液
如图是KNO3和NH4Cl的溶解度曲线,下列叙述错误的是( )
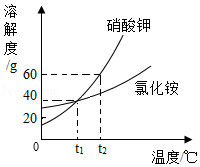
A.t1℃时,KNO3的溶解度与NH4Cl的溶解度相等
B.t2℃时,KNO3饱和溶液中溶质的质量分数是37.5%
C.t1℃时,NH4Cl的不饱和溶液降温,肯定无晶体析出
D.t2℃时,KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数
K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如图。下列说法正确的是( )
温度/℃ |
20 |
40 |
50 |
60 |
80 |
|
溶解度/g |
K2CO3 |
110 |
117 |
121 |
126 |
139 |
KNO3 |
31.6 |
63.9 |
85.5 |
110 |
169 |
|
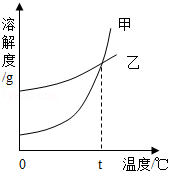
A.K2CO3的溶解度大于KNO3
B.乙代表K2CO3的溶解度曲线
C.t应在50℃~60℃之间
D.40℃时,100g KNO3饱和溶液中含63.9g KNO3
20℃时KCl的溶解度是34g。取65g KCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )

A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是( )
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
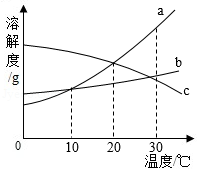
A.a、b两种物质的溶解度相等
B.a、b、c三种物质的溶解度大小顺序为a>b>c
C.从0℃到30℃时,随着温度的升高,c物质的溶解度变化最小
D.温度从10℃到20℃时,a、b两种物质的溶解度都在增大,其中a物质的溶解度受温度影响较大
以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
|
Na2CO3的溶解度(g/100g水) |
7.1 |
12.5 |
21.5 |
39.7 |
49.0 |
48.5 |
46.0 |
NaHCO3的溶解度(g/100g水) |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的 NaHCO3会部分析出