将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液中,搅拌,使其充分反应后,过滤,滤纸上留下的金属是( )
| A.Ag | B.Fe、Ag | C.Zn、Fe | D.Zn、Fe 、Ag |
某固体样品中除了含有在高温下不分解,也不与空气成分反应的物质外,还可能含有 CaCO3、CaO中的一种或两种。某化学兴趣小组为探究该固体的成分,称量样品m1 g,经 高温充分煅烧并在干燥的保护气中冷却,至质量不再减轻为止,剩余固体的质量为m2 g。下列推断不正确的是( )
| A.若m1=m2,则原样品中无CaCO3 |
| B.若m1<m2,则原样品中一定有CaCO3 |
C.若 <m2<m1,则原样品中一定有CaO <m2<m1,则原样品中一定有CaO |
D.若 <m2<m1,则原样品中一定无CaO <m2<m1,则原样品中一定无CaO |
将7.2克CO和CO2的混合气体缓缓通入足量灼热的氧化铜(假设反应进行完全),得到6.4克铜,并把反应后的气体全部通入足量的澄清石灰水中,会得到一种白色沉淀。求:
(1)原反应物中CO和CO2各多少克?
(2)白色沉淀的质量为多少克?
仿照下图中C→CO转化的表示方法,将下图中C、CO、CO2、H2CO3、CaCO3等五种物质之间的转化关系用“→”连接起来,并在箭头旁标明必需的其他反应物及反应条件。
实验室里,用如右图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法不正确的是( )
| A.实验开始时,应该先点燃酒精灯,一段时间后再通入一氧化碳 |
| B.实验过程中,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 |
| C.实验结束后,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 |
| D.该反应中,一氧化碳转化为无毒无害的二氧化碳,故不需要尾气处理装置 |
在用白磷(白磷与红磷组成相同,着火点为40℃)探究质量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示。请回答下列问题: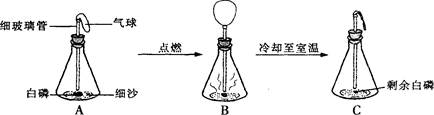
(1)实验中观察到B中气球变大,解释产生此现象的原因是:
。
(2)实验观察到A、C中气球的大小不同,解释产生此现象的原因是:
。
(3)将C再次放到天平上称量,天平仍然平衡,在此化学反应中,从具体的反应物和生成物分析天平平衡的原因是 。
比较、分析、归纳是学习化学的重要方法。通过比较可以发现相同的反应物在不同外界条件下,会发生不同的反应。请参照示例归纳反应规律:
| 组别 |
化学方程式 |
规律 |
| 示例 |
 |
反应物相同时,反应物的量不同,生成物不同 |
| (1) |
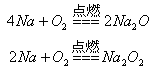 |
|
| (2) |
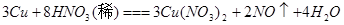 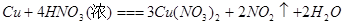 |
|
质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)已知m1g镁条放在空气中完全燃烧,生成m2g氧化镁(不考虑其它反应),该反应的化学方程式 ,m1 m2 。(填“大于”、“小于”或“等于”)。
(2)小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因是 。
在小烧杯A中加入20mL蒸馏水,滴入2~3滴紫色石蕊试液,得到的溶液呈紫色。在小烧杯B中加入20mL浓盐酸(盐酸是氯化氢气体溶于水形成的溶液);用一只大烧杯把A、B两个烧杯罩在一起(如图所示)。过几分钟,看到烧杯A中的溶液变成红色。
(1)你认为烧杯A中的溶液变红的原因可能有哪些?
假设1: ;
假设2: 。
(2)请设计简单的实验,探究你的假设(简述操作方法):
验证假设1的实验: ;
验证假设2的实验: 。
(3)通过实验探究,获得的结论是 。
下图(Ⅰ)是电解水的简易装置,(Ⅱ)是电解水生成气体体积与时间的关系图,试回答下列问题:(甲管生成气体A、乙管生成气体B)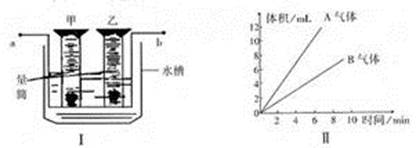
(1)图中a、b两级分别是电源的 极和 极。
(2)气体B可以用带火星的木条检验,现象是 ,说明气体B能够 ;气体A能够 ,火焰呈淡蓝色,混有一定量空气的气体A遇明火会发生 。
(3)甲、乙两个量筒内汇集的气体体积比约为 。
(4)此实验中发生反应的符号表达式为 。
(5)用分子、原子的观点来解释,在电解水的实验过程中, 分解成______和 ,它们再重新组合成 和 。
不能反映相关实验过程中量的变化的图像是( )
| A.电解水 | B.过量镁、锌分别和等质量等浓度盐酸反应 |
| C.在碳酸钡中不断滴加硫酸溶液 | D.在氢氧化钠和碳酸钠的混合溶液中滴加盐酸 |
下列各组稀溶液中,不用其他任何实际就能鉴别出来的是( )
| A.Na2CO3、HCl、H2SO4、Na2SO4 | B.Na2SO4、NaOH、CuSO4、NaCl |
| C.HCl、AgNO3、HNO3、NaCl | D.FeCl3、NaOH、HCl、NaCl |
推理是化学学习中常用的思维方法。下列推理正确的是( )
| A.点燃H2和O2混合气体可能爆炸,所以点燃H2与CO的混合气体也可能爆炸 |
| B.CO2能与NaOH溶液反应,所以CO也能与NaOH溶液反应 |
| C.碱溶液的pH大于7,Ba(OH)2是碱,所以氢氧化钡溶液的pH大于7 |
| D.中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应 |
下列实验设计正确的是
| A.分离溶液中FeCl2和Cu(NO3)2 |
| B.检验氢气燃烧的产物 |
| C.用氢氧化钠溶液检验某未知溶液是否含碳酸钾 |
| D.去除混合气体中的CO |
右图是某种加钙食盐(在加碘食盐中掺适量的食用碳酸钙)包装标签上的部分文字。为了测定此盐中的碳酸钙含量,取10 g这种盐溶于水,加入足量盐酸,生成0.132 g二氧化碳。计算此加钙食盐中碳酸钙的质量分数。