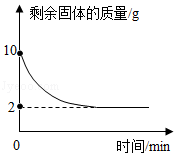
某化工产品的成分是碳酸钙、氢氧化钙和硫酸钡,现取该化工产品样品20g放入锥形瓶内,向其中加适量水,振荡,然后再向锥形瓶中滴加溶质质量分数为10%的稀盐酸,反应生成二氧化碳的质量与加入稀盐酸的质量关系如图所示。请回答下列问题:
(1)该样品中钙元素的质量分数是 (只填空,不列式计算)。
(2)计算该样品中氢氧化钙的质量。

2020年6月8日是第12个"世界海洋日",海洋是巨大的资源宝库。某课题小组模拟工业海水提镁的流程,在实验室制取生产镁的原料﹣﹣氯化镁,设计方案如图:

【信息】1.海水和苦卤中都含有NaCl、Na 2SO 4、MgCl 2、CaCl 2、KCl等。
2.苦卤是海水晒盐后剩余的溶液。
3.下表是某品牌不同碱的价格。
| 试剂 |
NaOH |
Ca(OH) 2 |
Ba(OH) 2 |
KOH |
| 价格(元/吨) |
2400 |
850 |
5300 |
5500 |
请分析与计算。
(1)海水和苦卤都可以作为制取氯化镁的原料,甲同学提出选择苦卤更好,小组同学一致同意他的观点,理由是 。
(2)在工业生产中为了降低成本,试剂X最好选择表格中的 。
(3)该方案制取氯化镁时,要经历步骤Ⅰ和步骤Ⅱ两步转化,其主要目的是 。
(4)小组同学按上述方案进行了实验,并制得19.0g干燥纯净的氯化镁固体。若步骤Ⅱ中溶质质量分数为10%的稀盐酸与氢氧化镁恰好完全反应,且步骤Ⅲ中氯化镁没有损失,求步骤Ⅱ中消耗稀盐酸的质量。(写出计算步骤)
生铁是由铁和碳组成的合金。某化学兴趣小组的同学为了测定某稀盐酸中溶质的质量分数,取一定量的该生铁样品,分四次加入稀盐酸200g,充分反应后,实验数据如下:
| 次数 |
1 |
2 |
3 |
4 |
| 稀盐酸质量/g |
50 |
50 |
50 |
50 |
| 氢气质量/g |
0.2 |
m |
0.2 |
0.1 |
请根据有关信息完成下列问题:
(1)m= 。
(2)该稀盐酸中溶质的质量分数。(请写出计算过程,计算结果精确到0.1%)
生铁和钢都是铁和碳的合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%.化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品盛放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
| 次数 |
加盐酸前 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀盐酸的质量(g) |
0 |
20 |
20 |
20 |
20 |
20 |
| 锥形瓶内物质的总质量(g) |
11.5 |
31.4 |
m |
71.2 |
91.1 |
111.1 |
【查阅资料】碳不与稀盐酸反应。
请回答下列问题:
(1)根据质量守恒定律,该反应中生成气体的总质量为 。
(2)实验数据表中m的值为 。
(3)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。
甲、乙、丙三个实验小组分别利用2g铜粉"测定空气中氧气的含量",实验装置见图。课外兴趣小组为研究实验中铜粉的氧化情况,又进行以下实验:
①兴趣小组将甲、乙、丙三个实验小组硬质玻璃管中的残留固体全部取出,称量后,置于烧杯中;
②在烧杯中加入足量稀硫酸使之充分反应,将剩余固体过滤、洗涤、干燥、称量;相关数据见下表:
| |
甲组 |
乙组 |
丙组 |
| 反应前固体质量 |
2.016g |
2.016g |
2.024g |
| 反应后固体质量 |
1.936g |
1.936g |
1.904g |
(1)烧杯中发生反应的化学方程式为 ;
(2)甲、乙两组实验数据相同,残留固体中氧化铜的质量为 ,丙组残留固体中氧化铜的质量为 。
(3)兴趣小组通过分析数据得出:甲、乙两组实验数据更接近实际空气中氧气的含量,丙组差异较大。你认为丙组在"测定空气中氧气的含量"实验中,可能存在的操作失误是 。
白铜(Cu﹣Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:

试问:
(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数(写出计算过程)。
某兴趣小组在实验室发现盛有固体氢氧化钠的试剂瓶破裂瓶盖处有"白毛"状物质(如图),根据所学知识,他们推断"白毛"状固体物质中含有碳酸钠,依据是 。他们取5g白色固体,加水配成20g溶液倒入烧杯中,将40g氯化钡溶液分成四等份,分4次加入烧杯中,充分反应后测得数据如下表:
| 实验次数 |
1 |
2 |
3 |
4 |
| 加入氯化钡溶液的质量/g |
10 |
10 |
10 |
10 |
| 烧杯中所得溶液的质量/g |
28.03 |
36.06 |
44.09 |
54.09 |
(1)第 次实验,加入的氯化钡与碳酸钠恰好完全反应。
(2)求5g白色固体中碳酸钠的质量。(写出计算过程,结果保留两位小数)

"蛟龙号"是我国研制出的大深度载人潜水器。为保证载人潜水器长时间潜水,需要在潜水器里配备供氧装置。过氧化物供氧是一种常见的供氧技术,原理是用过氧化钠(化学式为Na 2O 2)固体常温下与二氧化碳反应,生成碳酸钠和氧气。若用这种方法制取96g氧气,则至少需要多少克过氧化钠?
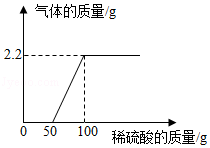
某校化学兴趣小组同学,将一定量的稀硫酸滴入9.3g氢氧化钠和碳酸钠的固体混合物中,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
(1)产生二氧化碳气体的质量为 ;
(2)混合物与稀硫酸恰好完全反应时所得溶液中溶质的质量是多少?
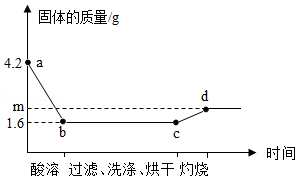
取一定量铜粉、铁粉的混合物,加入过量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。固体质量与各步实验的时间关系如图。(1)b点时溶液中溶质的化学式为 。
(2)原粉状混合物中铁粉的质量为 g。
(3)求m的值。(写出计算过程)
某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取20g该固体混合物,向其中逐滴加入稀H2SO4,测得剩余固体的质量与加入稀H2SO4的质量关系如图所示。回答下列问题:

(1)写出滴加稀H2SO4时发生反应的化学方程式 。
(2)该固体混合物中铜元素的质量为 。
(3)计算稀H2SO4中溶质的质量分数(写出计算过程)。
实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入192g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示。
(1)所取粉末中氧化铜的质量为 g;
(2)计算反应后所得溶液溶质质量分数。(规范写出计算过程)
用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 |
优良品 |
一级品 |
二级品 |
氯化钾质量分数(≥) |
93.00% |
90.00% |
87.00% |
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
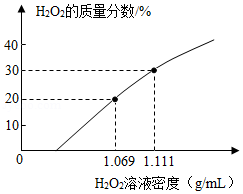
在新冠肺炎的疫情防控中,过氧化氢(H2O2)广泛用于环境消毒,在放置过程中会缓慢分解。某单位有一桶未曾使用过的久置的H2O2溶液,观测得其溶液密度为1.069g/mL,该温度下溶液的密度和溶质质量分数的对应关系如图。桶上标签提供的信息:①H2O2的质量分数为30%;②内装溶液质量50kg,完成下列问题:
(1)该久置的H2O2溶液的溶质质量分数为 。
(2)若用此久置的H2O2溶液来配制质量分数为3%的环境消毒液200kg,需用这种H2O2溶液 kg。
(3)若这桶H2O2溶液放置至完全分解,桶中剩下的液体质量是多少?(假设液体不挥发,通过计算回答,结果精确到0.1)