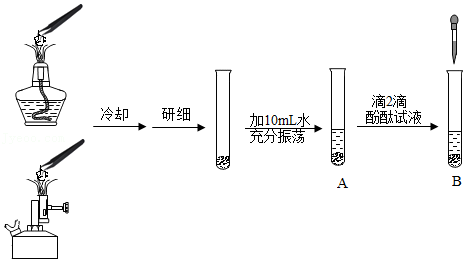
某化学课堂围绕“酸碱中和反应”,将学生分成若干个小组展开探究。以下是教学片断,请你参加学习并填写空格。
【演示实验】将一定质量的稀盐酸加入盛有NaOH溶液的小烧杯中。
【提出问题】实验中未观察到明显现象,某同学提出疑问:反应后溶液中溶质是什么?
【猜憲与假设】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下,请补上猜想二。
猜想一:只有NaCl
猜想二:
猜想三:NaCl和HCl
猜想四:NaCl、NaOH和HCl
乙组同学认为有一种猜想不合理,不合理的猜想是 ,理由是 。
【实验探究】
(1)丙组同学取烧杯中的溶液少许于试管中,滴加几滴CuCl2溶液, (填实验现象),证明溶液中一定没有NaOH。
(2)为了验证其余猜想,各学习小组利用浇杯中的溶液,并选用了老师提供的pH试纸、K2CO3溶液、AgNO3溶液,进行如下三个方案的探究。
实验方案 |
测溶液的pH |
滴加K2CO3溶液 |
滴加AgNO3溶液 |
实验操作 |
|
|
|
实验现象 |
试纸变色,对照比色卡,pH<7 |
|
产生白色沉淀 |
实验结论 |
溶液中有HCl |
溶液中有HCl |
溶液中有HCl |
【得到结论】通过探究,全班同学一致认为猜想 正确。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论的活动过程给予肯定,同时指出(2)中存在两处明显错误。同学们经过反思发现以下两处错误:
①实验操作中的错误是 。
②实验方案中也有一个错误,错误的原因是 。
石灰石是重要的化工原料。为研究石灰石的性质和用途进行如下探究。
Ⅰ.石灰石分解的探究
取三块形状大小相近的石灰石(长宽厚约为1cm×1cm×0.2cm),一块不加热,另两块分别在酒精灯和酒精喷灯(酒精化学式为C2H5OH)的火焰上加热2min(假设杂质加热时不发生变化)。探究过程如图所示,实验现象见表1。
表1 不同条件下的实验现象
实验组别 |
实验条件 |
试管B中的现象 |
甲 |
未加热 |
无明显现象 |
乙 |
酒精灯加热 |
呈浅红色 |
丙 |
酒精喷灯加热 |
呈红色 |
(1)通过甲、乙、丙三组对比实验,得出影响石灰石分解的因素是 。
(2)丙组实验加热石灰石时,在火焰上方倒扣一个用澄清石灰水润湿的烧杯,石灰水变浑浊,出现浑浊的化学方程式为 。此实验能否推断石灰石煅烧产生二氧化碳,并说明理由: 。
(3)丙组实验中,向试管B中逐滴滴入稀盐酸,至红色恰好褪去,轻轻晃动试管,溶液自下而上又变为红色。解释产生上述现象的原因: 。
(4)为检验丙组实验中的石灰石部分分解,设计实验:取研细后的粉末少许于试管中,
(补充完整实验方案)。
Ⅱ.石灰石煅烧温度的探究
【查阅资料】生石灰质量的优劣常采用“活性度”来街量。“活性度”的测定方法:取一定质量的生石灰,加入一定量的水,用指定浓度的盐酸中和,记录所消耗盐酸的体积数(单位为mL)。消耗盐酸的体积数越大,“活性度”越高。
某研究小组在电炉内煅烧石灰石样品,并测定煅烧产物(CaO)的活性度,数据见表2。
表2 不同条件下煅烧产物的活性度(mL)
煅烧时间/活性度/煅烧温度 |
1050℃ |
1100℃ |
1150℃ |
1200℃ |
1250℃ |
1300℃ |
12min |
790 |
836 |
868 |
808 |
454 |
412 |
16min |
793 |
856 |
871 |
845 |
556 |
530 |
20min |
795 |
863 |
873 |
864 |
617 |
623 |
(5)石灰石煅烧的最佳温度范围为1100~1200℃的证据是 。
Ⅲ.石灰石用途的探究
(6)石灰石是高炉炼铁的原料之一。石灰石能除去铁矿石中的SiO2,同时能提高单位时间内生铁的产率。分析加入石灰石能提高生铁产率的原因: 。
硫酸亚铁是一种重要的补铁剂。实验室以废铁屑(含少量Fe2O3)为原料制备硫酸亚铁晶体的流程如图所示:
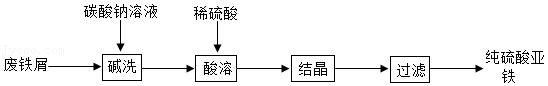
已知:铁与硫酸铁反应的化学方程式为Fe+Fe2(SO4)3═3FeSO4。
(1)“碱洗”是为了洗去铁屑表面的油污。用热的碳酸钠溶液浸泡,过滤,再用蒸馏水洗涤2~3次。取最后一次洗涤液,测其pH,若pH= ,说明洗涤液中无碳酸钠。
(2)“酸溶”是向“碱洗”过的铁屑中加入过量稀硫酸。
①写出铁与稀硫酸反应的化学方程式: 。
②所用硫酸溶液浓度不能太稀,原因是 。
③废铁屑中的少量Fe2O3不需要进行除杂处理,原因是 。
(3)“结晶”的相关操作依次为:蒸发浓缩、降温结晶。蒸发浓缩的目的是 ,便于结晶。
(4)含量测定:准确称取制得的硫酸亚铁样品2.82g于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加溶质质量分数为1.58%的高锰酸钾溶液,当恰好完全反应时,消耗高锰酸钾溶液的体积为20.00mL(该高锰酸钾溶液密度近似为1g•mL﹣1)。列式计算该样品中硫酸亚铁的含量(结果用百分数表示,保留一位小数)。
已知:高锰酸钾与硫酸亚铁反应的化学方程式为10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O(相对分子质量:FeSO4=152,KMnO4=158)
某兴趣小组的同学对二氧化碳的制取和相关性质进行探究。
【气体制取】
(1)实验室用大理石与稀盐酸(1:2)制取二氧化碳的化学方程式为 。
(2)稀盐酸(1:2)是指浓盐酸与水按体积比1:2进行混合所得的盐酸。已知所用浓盐酸中溶质的质量分数为37%,密度为1.19g/cm3;水的密度为1g/cm3。计算所得稀盐酸中溶质的质量分数(计算结果保留一位小数)。
【实验探究】用实验证明碳酸型饮料(如汽水)中含有二氧化碳。
兴趣小组同学用如图所示的装置进行实验:打开汽水瓶盖,立即塞上带导管的橡皮塞,将导管另一端伸入装有试剂的试管中。甲、乙两位同学分别用不同的试剂进行实验。
甲同学在试管中加入少量澄清石灰水,观察到试管内 ,由此得到结论:该汽水中含有二氧化碳。
乙同学在试管中加入少量紫色石蕊溶液,观察到试管内 ,乙同学认为也能得到甲同学的结论。
【评价反思】兴趣小组的同学对甲、乙两位同学的实验方案进行评价。
(1)丙同学认为甲同学的方案比较合理,其试管中发生反应的化学方程式为 。
(2)丁同学质疑乙同学的方案不够严密,认为也可能是该汽水中的柠檬酸随气体进入试管,而引起紫色石蕊溶液的变色。兴趣小组的同学针对丁同学提出的质疑进行了如下探究:
①查阅资料:柠檬酸为无色晶体,易溶于水和酒精;常温稳定,熔点153℃,熔化后沸腾前分解,分解温度约为175℃;柠檬,柑橘等水果中含有柠檬酸。
②乙同学在自己实验的基础上,未增加任何试剂,接着进行了一步实验操作,该操作是 ,可观察到 ,该反应的化学方程式为 。可以确认不是因为柠檬酸而引起紫色石蕊溶液的变色。
某兴趣小组利用压强传感器研究氢氧化钠溶液吸收二氧化碳的情况。用3个250mL的烧瓶收集满纯净的二氧化碳,连接压强传感器,同时采集数据,用注射器同时等速度分别注入三种不同浓度的氢氧化钠溶液各15mL,片刻后,同时振荡烧瓶,等待反应完成。采集的数据如图所示。下列说法正确的是( )

| A. |
0~t 1段曲线呈现这种形态是因为注入氢氧化钠溶液后未进行振荡 |
| B. |
t 1~t 2段曲线呈现这种形态是因为注入氢氧化钠溶液后进行振荡 |
| C. |
a、b、c三种曲线所示的实验中,t 3时烧瓶内压强由大到小的顺序是a>b>c |
| D. |
a、b、c三种曲线所示的实验中,t 3时被吸收的二氧化碳的体积由大到小的顺序是a>b>c |
碳酸氢钠是一种应用广泛的盐,化学小组对其进行了探究。
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和 (填离子符号)构成,医疗上能用于治疗胃酸(含有盐酸)过多症,反应的化学方程式为 。
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。
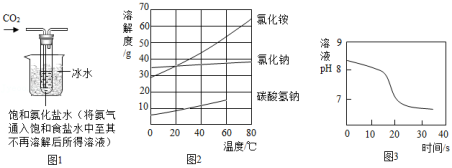
反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是 。
(3)能进一步确认该白色固体是NaHCO3的实验方案是
(须用到的仪器和药品:试管、温度计、水)。
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是 。
【性质探究】
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料三NaHCO3溶于水后,少量的HCO3﹣能同时发生如下变化:
变化①:HCO3﹣+H2O→H2CO3+OH﹣;
变化②:HCO3﹣→CO32﹣+H+。
材料四:溶液的酸碱性与溶液中H+和OH﹣数目的相对大小有关。常温下,当单位体积溶液中OH﹣的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显 (填“酸”“碱”或“中”)性,结合材料三、四从微观角度说明原因: 。
(6)根据本实验,下列说法错误的是 (填字母)。
a.pH<6.68时生成的无色气体为CO2
b.从0~30s,单位体积溶液中H+数目不断增大
c.不能用CaCl2溶液鉴别Na2CO3和NaHCO3溶液
在实验室中做硫在氧气中燃烧的实验,会生成有毒的SO2气体。
(1)为防止造成污染,进行实验时,可在集气瓶里预先放少量的 吸收SO2。
(2)0.5g硫粉在氧气中完全燃烧,理论上可生成SO2的质量是多少?(请利用化学方程式计算)
学习了常见的酸、碱、盐后,同学们对碱的化学性质进行整理归纳,并在教师的指导下进行如下实验活动。
【验证实验】
序号 |
实验一 |
实验二 |
实验三 |
实验四 |
实验内容 |
|
|
|
|
实验现象 |
溶液变 色 |
产生蓝色沉淀 |
无明显现象 |
无明显现象 |
分析与结论 |
Ca(OH)2能与指示剂作用 |
反应的化学方程式为 |
无法确定是否发生反应 |
无法确定是否发生反应 |
【发现问题】
通过实验,同学们发现实验三、实验四无明显现象,无法确定是否发生了化学反应。于是继续进行探究。
【探究实验】
Ⅰ.取少量实验三中的剩余溶液,滴加 溶液,溶液仍为无色,证明稀盐酸和Ca(OH)2溶液发生了化学反应,判断依据是溶液中 完全反应了。
Ⅱ.取少量实验四中的剩余溶液,滴加 溶液(填盐类物质),观察到产生白色沉淀,证明CO2和NaOH溶液发生了化学反应。
【拓展延伸】
同学们针对实验四又进行了如图所示的对比实验:将充满CO2的两支相同的试管分别倒扣入盛有不同液体的两个烧杯中,根据试管内液面上升的高度不同,确定二者之间发生了反应。请在图中?处填上适当的内容。
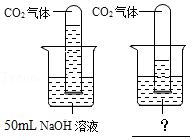
【总结提升】
(1)通过上述实验验证了碱溶液的化学性质。
(2)没有明显现象的化学反应,可以通过检验反应物消失(或减少)或有新物质生成的方法证明反应发生。
某化学兴趣小组绘制碱的化学性质,设计实验如图:

同学们选取四种碱来验证碱的化学性质,设计实验如图:
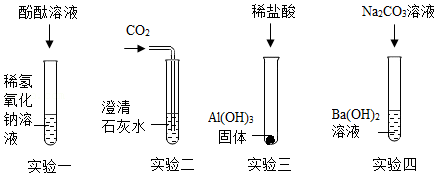
(1)实验一能够观察到的明显现象是溶液由无色变为 色;
(2)实验二澄清石灰水变浑浊,验证了上述知识网络图中碱能够与 反应;
(3)实验三发生反应的化学方程式为 ;
(4)实验四产生白色沉淀,对反应后的物质进行过滤,并对滤液中溶质的成分产生了兴趣,经分析,滤液中一定有氢氧化钠,滤液一定显 (选填“酸性”、“中性”或“碱性”);
【提出问题】滤液中溶质除了氢氧化钠还有什么呢?同学们对滤液中溶质的成分进行了猜想和实验探究。
【猜想与假设】猜想一:溶质只有NaOH;
猜想二:溶质为NaOH和 ;
猜想三:溶质为NaOH和Ba(OH)2。
【实验探究】
实验操作 |
实验现象 |
实验结论 |
a.取少量滤液于试管中,加入过量稀盐酸 |
无明显现象 |
由a、b两个实验的现象,得出猜想一正确 |
b.另取少量滤液于试管中,加入过量碳酸钠溶液 |
|
【反思与评价】
Ⅰ.同学们经过讨论认为,如果只向滤液中加入过量的一种试剂,也能得出猜想一正确的结论,该试剂为 ;
Ⅱ.实验后的废液直接倒入下水道,会造成环境污染,需将废液处理后再排放。
某工厂废水经初步处理后可得CuSO4和H2SO4的混合溶液,华雪同学设计实验模拟后续处理过程,并得到了Cu和另一种重要化工原料绿矾(FeSO4•7H2O)。其过程如图:

(1)参加反应的CuO质量为 g。
(2)若原混合溶液质量为200g,求混合溶液中H2SO4的质量分数(写出计算过程)。
(3)若反应消耗11.2g Fe,求理论上可得到绿矾的质量(写出计算过程)。
将一定质量的Na 2CO 3和NaOH混合物与60g质量分数为18.25%的盐酸混合,两者恰好完全反应,收集到4.4g气体,则原混合物中NaOH的质量为( )
| A. |
2g |
B. |
3g |
C. |
4g |
D. |
5g |
为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
【实验内容与分析】
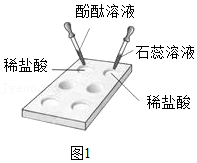
实验一:按如图1所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3克Na2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊溶液变 色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因 。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞) (用化学式表示)。
(4)请计算,实验四中理论上可以生成二氧化碳的质量为 克。
(可能用到的相对原子质量:H﹣1 C﹣12 O﹣16 Na﹣23 Cl﹣35.5)
【应用与拓展】
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜 。
(6)小明在征得老师的同意后,继续进行了如图2所示实验。
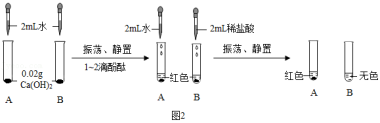
由上述实验可以得出氢氧化钙的哪些性质 。
取溶质质量分数为5%的过氧化氢溶液60.0g于锥形瓶中,加入一定量的二氧化锰,反应完全(假定过氧化氢全部分解,产生的氧气全部逸出,水的蒸发忽略不计)。请分析并计算:
(1)上述过氧化氢溶液完全反应后,产生氧气的质量是多少?(写出详细的计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8g,根据二氧化锰在该反应中所起的作用,可知加入二氧化锰的质量应为 g。
我国制碱工业先驱侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展作出了杰出的贡献。纯碱的用途非常广泛,某化学兴趣小组的同学对它产生了浓厚的兴趣,设计了如图两个实验,并对反应后试管中残留废液进行探究。
【实验1】往一支盛有碳酸钠溶液的试管中滴加无色酚酞溶液,观察到溶液变成 色。
【实验2】往另一支盛有碳酸钠溶液的试管中滴加稀盐酸,观察到的现象是 。同学们对实验2反应后的废液中溶质成分进行探究。
【提出问题】废液中所含溶质是什么?
【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl
猜想二:废液中的溶质可能是NaCl、Na2CO3
猜想三:废液中的溶质可能是
【设计实验】同学们为验证猜想,设计了如下实验:
方案一:
实验操作与现象 |
反应方程式 |
实验结论 |
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生 |
|
猜想二正确 |
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。
【进行讨论】同学们一致认为小明的实验结论不正确,理由是 。
【进行总结】分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑 。
【拓展与应用】现有14.9克纯碱样品(含Na2CO3和NaCl的混合物),将其放入干净的烧杯中,加入89.5克水使其完全溶解,向所得溶液中缓慢加入一定溶质质量分数的稀盐酸(反应方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O)。产生气体的质量与加入稀盐酸的质量关系如图所示,试回答下列问题:
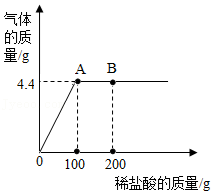
(1)产生CO2的质量为 克。
(2)所用稀盐酸中溶质的质量分数是多少? (写出具体的解题过程,下同)
(3)滴入稀盐酸至恰好完全反应时,所得溶液中溶质的质量分数是多少?
