硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________ 形。
(2)根据价层电子对互斥理论, , , 的气态分子中,中心原子价层电子对数不同于其他分子的是________。
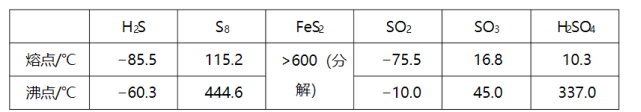
(3)图(a)为 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为________。
(5) 晶体的晶胞如图(c)所示,晶胞边长为 , 相对式量为M、阿伏伽德罗常数的值为 , 其晶体密度的计算表达式为________ ;晶胞中 位于 所形成的正八面体的体心,该正八面体的边长为________ nm
砷(As)是第四周期VA族元素,可以形成 、 、 、 等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图__________。
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入 氧化,生成 和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________。
(3)已知:
则反应 的 __________。
(4)298K时,将 、 和 溶液混合,发生反应: 。溶液中 与反应时间(t)的关系如图所示。
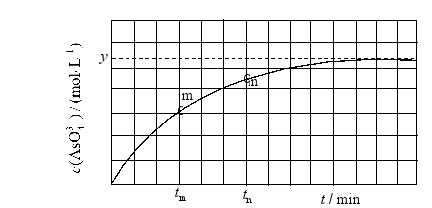
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.
c. 不再变化
d.
② 时, __________ (填"大于"、"小于"或"等于")。
③ 时 __________ 时 (填"大于"、"小于"或"等于"),理由是__________。
④若平衡时溶液的 ,则该反应的平衡常数K为__________。
催化重整不仅可以得到合成气(CO和
)。还对温室气体的减排具有重要意义。回答下列问题:
(1) 催化重整反应为: 。
已知:
该催化重整反应的 ________ 。有利于提高 平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时 的转化率是50%,其平衡常数为________ 。
(2)反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
| |
积碳反应
|
消碳反应
|
|
|
|
75 |
172 |
|
| 活化能/ |
催化剂X |
33 |
91 |
| 催化剂Y |
43 |
72 |
|
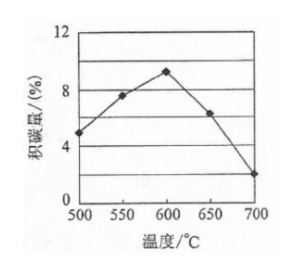
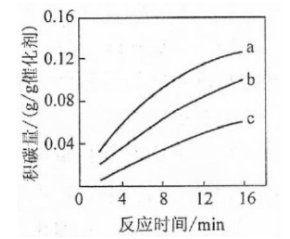
①由上表判断,催化剂X________Y(填"优于或劣于"),理由是________.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)
| A. | 、 均增加 |
| B. | 减小、 增加 |
| C. | 减小、 增加 |
| D. | 增加的倍数比 增加的倍数大 |
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在 一定时,不同 下积碳量随时间的变化趋势如右图所示,则 、 、 从大到小的顺序为________
过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态 原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比 电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(3) 中配体分子 、 以及分子 的空间结构和相应的键角如图所示。
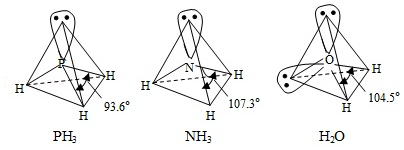
中 的杂化类型是 。 的沸点比 的 ,原因是 。 的键角小于 的,分析原因 。
(4)在金属材料中添加 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图所示。处于顶角位置的是 原子。设 和 原子半径分别为 和 ,则金属原子空间占有率为 %(列出计算表达式)。

局部麻醉药福莫卡因的一种合成路线如图:
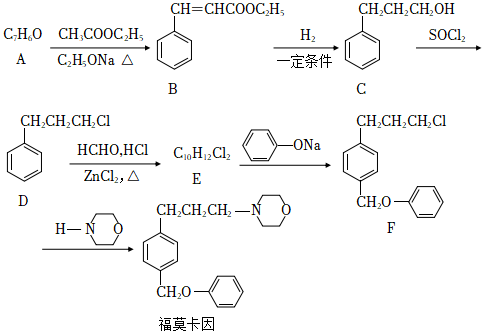
回答问题:
(1)A的结构简式:_____,其化学名称_____。
(2)B中所有官能团名称:__________。
(3)B存在顺反异构现象,较稳定异构体的构型为_____式(填“顺”或“反”)。
(4)B→C的反应类型为_____。
(5)与E互为同分异构体之——X,满足条件①含有苯环②核磁共振氢谱只有1组吸收峰,则X的简式为:_____(任写一种)。
(6)E→F的反应方程式为__________。
(7)结合上图合成路线的相关信息。以苯甲醛和一两个碳的有机物为原料,设计__________。
【选修三:物质结构与性质】磷酸亚铁锂(
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
、
、
和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填"相同"或"相反")。
(2) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为________,其中Fe的配位数为________。
(3)苯胺  )的晶体类型是________。苯胺与甲苯(
)的晶体类型是________。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
(4) 中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5) 和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
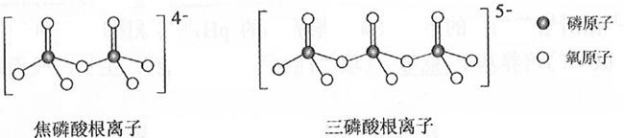
这类磷酸根离子的化学式可用通式表示为________(用 n代表P原子数)。
一氯化碘 是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是 ,从而错过了一种新元素的发现。该元素是 。
(2)氯铂酸钡 固体加热时部分分解为 、Pt和 , 时平衡常数 。在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在 ,碘蒸气初始压强为 。 平衡时,测得烧瓶中压强为 ,则 ,反应 的平衡常数 (列出计算式即可)。
(3)McMorris 测定和计算了在 范围内下列反应的平衡常数 :
得到 和 均为线性关系,如图所示:
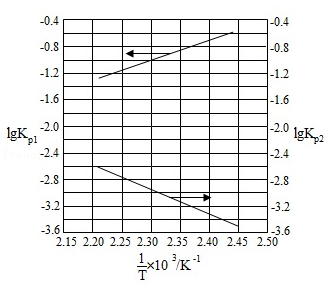
①由图可知, 分解为 和 反应的 (填"大于"或"小于")。
②反应 的 (用 表示);该反应的 (填"大于"或"小于"),写出推理过程 。
(4)Kistiakowsky曾研究了 光化学分解反应,在一定频率(v)光的照射下机理为:
其中 表示一个光子能量, 表示 的激发态。可知,分解 的 需要吸收 的光子。
【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH 3的________(填"高"或"低"),其判断理由是________。
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f 66s 2 , Sm 3+的价层电子排布式为________。
(3)比较离子半径:F −________O 2−(填"大于"等于"或"小于")。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
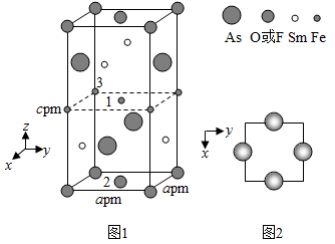
图中F −和O 2−共同占据晶胞的上下底面位置,若两者的比例依次用 x和1− x代表,则该化合物的化学式表示为________,通过测定密度 ρ和晶胞参数,可以计算该物质的 x值,完成它们关系表达式: ρ=________g·cm −3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( , , ),则原子2和3的坐标分别为________、________。
[化学--选修3:物质结构与性质]
我国科学家最近成功合成了世界上首个五氮阴离子盐 (用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
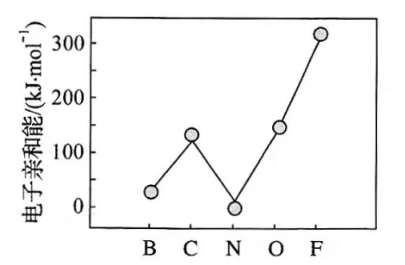
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( E 1)。第二周期部分元素的 E 1变化趋势如下图所示,其中除氮元素外,其他元素的 E 1自左而右依次增大的原因是___________;氮元素的 E 1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
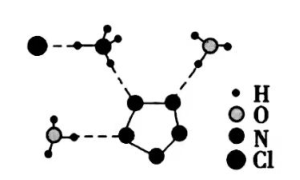
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.立体结构D.共价键类型
②R中阴离子 中的σ键总数为________个。分子中的大π键可用符号 表示,其中 m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则 中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为( )N−H…Cl、____________、____________。
(4)R的晶体密度为 ,其立方晶胞参数为 anm,晶胞中含有 y个[ ]单元,该单元的相对质量为 M,则 y的计算表达式为______________。
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ________ (填"大于"或"小于")。原因是________。
(3) 具有较高的熔点(872 ℃),其化学键类型是________; 不溶于有机溶剂而 、 、 能够溶于乙醇、乙醚等有机溶剂,原因是________。
(4)《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。 中,阴离子空间构型为________,C原子的杂化形式为________。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为________。六棱柱底边边长为 acm,高为 ccm,阿伏加德罗常数的值为 , Zn的密度为________ (列出计算式)。
[生物——选修3:现代生物科学技术]
人类疾病的转基因动物模型常用于致病机理的探讨及治疗药物的筛选。利用正常大鼠制备遗传性高血压转基因模型大鼠的流程如图所示。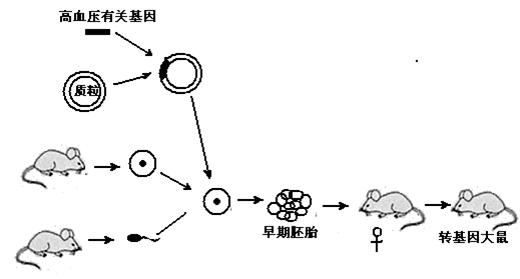
(1)卵母细胞除从活体输卵管中采集外,还可从已处死的雌鼠________中获取。
(2)图中的高血压相关基因作为__________,质粒作为_________,二者需用________切割后连接成重组载体,该过程与质粒上含有________有关。
(3)子代大鼠如果________和__________,即可分别在分子水平和个体水平上说明高血压相关基因已成功表达,然后可用其建立高血压转基因动物模型。
(4)在上述转基因大鼠的培育过程中,所用到的主要胚胎工程技术是___________、早期胚胎培养和胚胎移植。
[生物——选修1:生物技术实践]
许多植物含有天然香料,如薄荷叶中含有薄荷油。现用薄荷叶提取薄荷油。
回答问题:
(1)薄荷油是挥发性物质,提取薄荷油时应选用____(鲜、干)薄荷叶作原料,其原因是_____。
(2)用萃取法提取薄荷油时,采用的溶剂是______,原理是_______。
(3)用水蒸气蒸馏法提取薄荷油时,在油水混合物中加入氯化钠的作用是______。常用于分离油层和水层的器皿是______。分离出的油层中加入无水硫酸钠的作用是______,除去固体硫酸钠的常用方法是_______。
下图甲表示在一定条件下测得的该植物光照强度与光合速率的关系;图乙表示某绿色植物的细胞代谢状况;图丙是某兴趣小组将植物栽培在密闭玻璃温室中,用红外线测量仪测得室内的CO2浓度与时间关系的曲线。请分析回答: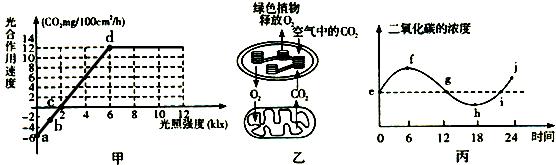
(1)图甲中的a点表示______,c点时,叶肉细胞中产生ATP的场所有 。
(2)图乙所示的该植物细胞代谢情况,可用图甲中a、b、c、d四点中的哪一点来表示?
。
(3)在光照强度大于____klx时,植物才会表现出生长现象。在相同温度下,将该植物的叶片置于8 klx光照下9小时,然后移到黑暗处15小时,则该24小时内每100 cm2叶片的光合作用所消耗的CO2的量为 mg。
(4)若图甲曲线表示该植物在25℃时光照强度与光合速率的关系,并且已知该植物光合作用和呼吸作用的最适温度分别为25℃和30℃,那么在原有条件不变的情况下 ,将温度提高到30℃,理论上分析c点将____(左移、右移、不变)。
,将温度提高到30℃,理论上分析c点将____(左移、右移、不变)。
(5)由图丙可推知,密闭玻璃温室中氧气浓度最大的是________点,光合速率与呼吸速率相等的点是______,j点与e点相比植物体内有机物含量将_______(增加、减少、不变)。
在小鼠中,有一复等位基因:A控制黄色,纯合子致死;a1控制鼠色,野生型;a2控制非鼠色(黑色)。这一复等位基因系列位于常染色体上,A对a1、a2为显性,a1对a2为显 性。AA个体在胚胎期死亡。请回答:
性。AA个体在胚胎期死亡。请回答:
(1)若Aa2(黄)×a1a1(鼠色)交配,其子代的表现型是 。
(2)假定进行很多Aa2×a1a2的杂交,平均每窝生8只小鼠。在同样条件下,进行很多Aa2×Aa2杂交,预期每窝平均生____只小鼠,其表现型及比例为 。
(3)一只黄色雄鼠(A_)与几只鼠色雌鼠(a1a2)杂交,在子代中____(能、不能)同时得到鼠色和非鼠色小鼠。原因是  。
。
下图甲是某高等动物细胞亚显微结构示意图,图乙是该动物体内5个不同分裂时期细胞图。请据图回答以下问题。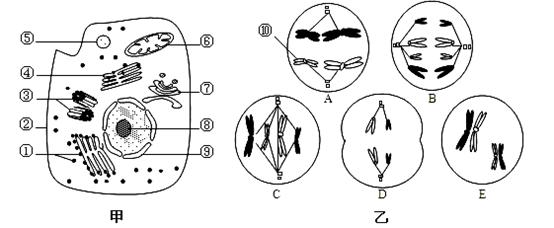
(1)②上的 在细胞互相识别时起重要作用。K+在进入甲细胞时,需要消耗细胞质基质以及[ ] (填序号和名称)提供的能量,这表明K+的跨膜运输方式是 。
(2)细胞中蛋白质的“装配车间”是[ ] (填序号和名称)。甲图中[ ]
] (填序号和名称)。甲图中[ ]
(填序号和名称)是膜面积最大的细胞器,为多种酶提供了大量的附着位点,有利于膜上化学反应的进行。
(3)在乙图中:[⑩]染色体上有 条脱氧核苷酸链。含有四个染色体组的细胞分裂图像是 (填字母),D所示的细胞和体细胞在染色体组成上的最大区别是 。乙图中代表减数分裂的细胞在减数分裂中出现的先后顺序
是 (填字母)。