胃酸过多是常见的胃病。甲、乙两种中学课本中用以治疗胃酸过多的常见胃药,以下是它们的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作 用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式: 。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:
; 。
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出),大部分反应在工业生产中得到实际应用。已知Ⅰ、G是单质,且Ⅰ是一种既能与酸反应又能与碱反应生成氢气的金属,L是一种无色气体,K是一种红棕色气体,E是一种红褐色沉淀。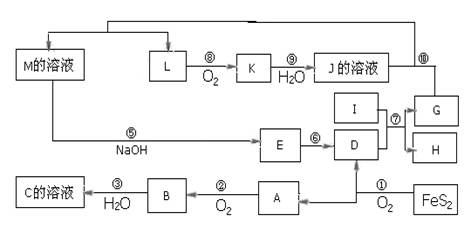
请填写下列空白:
(1)写出下列物质的化学式:C: ;J: 。
(2)写出下列反应的化学反应方程式:
反应⑦: 。
反应⑩: 。
(3)写工业上NH3与O2在一定条件下制取L的化学方程式: 。
下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其它为化合物,其中C为两性氧化物。试推断:
(友情提示:金属Al可在高温下将一些金属从其氧化物中置换出来)
(1)写出物质的化学式:
A: B: C: H:
(2)写出下列反应的方程式:
A→D反应的化学方程式
C→F反应的离子方程式
D→G反应的离子方程式
工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(可供选择的试剂:稀盐酸、NaOH溶液、稀氨水,CO2等)
请写出你所设计的方案中以下各步反应涉及的化学方程式.
①____________________________________________________________________
②____________________________________________________________________
④___________________________________________
已知A、B、C、D、E为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,甲、乙、丙为非金属单质,丁为地壳中含量最多的金属元素所组成的单质,C的焰色反应呈黄色,丙是黄绿色气体,它们之间的转化关系如图所示(有的反应部分产物已经略去):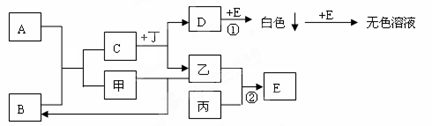
(1)实验室制取丙的化学方程式为 ,描述反应②的反应条件及现象
(2)反应①的化学方程式为:
(3)写出C与丙反应的离子方程式 ,列举这个反应的一种用途 。
已知某物质A有如下转化关系:
根据上图关系及实验现象,回答下列问题:
(1)A是 ,B是 ,G是 ,X是 (均填化学式)。
(2)写出反应Ⅱ的化学方程式 。
(3)写出反应Ⅲ的离子方程式 。
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时得到一种白烟Y和一种强酸Z,丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题
(1)戊离子的结构示意图为_______________。
(2)写出Y的电子式: ______。用电子式表示Z的形成过程:____________________
_____________________________________________________________________。
(3)写出丁的最高价氧化物的水化物与丙的最高价氧化物的水化物反应的离子方程式:___________ __________________________________________________________。
(4)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
考查知识点:由原子结构、元素及其化合物的性质推测性质。离子的结构示意图,电子式的书写,以及用电子式表示共价化合物的形成过程。氧化还原反应中,利用电子守恒的计算。
如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
根据图示回答问题:
(1)写出下列物质的化学式:B________,E________,I________;
(2)写出反应A+B→E+D的一种用途__________________;
(3)反应①的离子方程式是_________________________________________;
反应②的化学方程式是__________________________________________;
(4)J与盐酸反应的化学方程式是__________________ _________________;
反应后的溶液与D反应的离子方程式是___________________________________。
已知X、Y、Z都是中学化学中的常见三种气体,X为黄绿色,向X的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液颜色无明显变化;向Y的水溶液中滴入品红试液,品红褪色,将溶液加热后,溶液又呈红色;向Z的水溶液中滴入红色石蕊试液,溶液呈蓝色。据此回答下列问题:
(1)试写出下列物质的化学式:Y______________、Z________________;
(2)将X通入Y的水溶液中发生反应的离子方程式是 ;
(3)实验室制取Y的化学方程式是 。
A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可得到A,若向A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断:
(1)A是________,B是________,C是________,D是________。
(2)完成有关化学方程式:
C→A________________,A→C________________, B+C→A________________。
有机物A的相对分子质量小于150,其中含氧的质量分数为23.5%,完全燃烧只生成二氧化碳和水。有机物之间的相互转化如图(部分反应条件略)。
请回答下列问题:
(1)H和F中含有的官能团的名称分别为:H中______________;F中________________。
(2)有机物E的结构简式为_______________________________。
(3)有机物G能发生的反应类型有____________________(填字母)。
A.取代反应 B.加成反应 C.消去反应 D.加聚反应 E.氧化反应
(4)以M表示有机物的摩尔质量,则下列关系正确的是______________(填字母)。
A.M(A) =" M(B)" + M(C) B.M(D) =" M(G)" + 14
C.2M(F) + 18 =" M(D)" + M(G) D.M(D) > M(F) > M(G) > M(H)
(5)简述检验有机物F中的官能团的实验方法_______________________________________
___________________________________________________________________________________________________________________________________________________________。
(6)写出反应①的化学方程式:_______________________________________________;
写出能验证苯酚和碳酸酸性 强弱的化学反应方程式: _____________________________。
有机物A由C、H、O、Cl四种元素组成,其相对分子质量为198.5,Cl在侧链上。当A与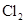 分别在Fe作催化剂和光照条件下以物质的量之比为l:1反应时,分别是苯环上一氯取代有两种和侧链上一氯取代有一种;A与
分别在Fe作催化剂和光照条件下以物质的量之比为l:1反应时,分别是苯环上一氯取代有两种和侧链上一氯取代有一种;A与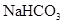 溶液反应时有气体放出。A经下列反应可逐步生成B~G。
溶液反应时有气体放出。A经下列反应可逐步生成B~G。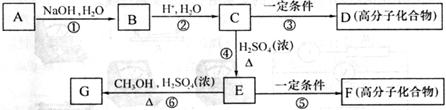
(1)A的化学式为______________;D的结构简式为______________;
(2)上述反应中属于取代反应的是______________ (填编号);
(3)C中含氧官能团的名称为______________、______________;
(4)E的同分异构体中,满足①苯环上只有一个侧链,且侧链上含有一个一CH ;②能
;②能
发生银镜反应;③属于酯类。则其结构简式为(写3种):__________、_______、__________
(5)写化学方程式(有机物写结构简式):
A与NaOH的醇溶液共热:__________________________________________________;
已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答下列问题: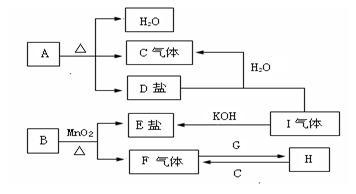
⑴B、D、I的化学式是B D I
⑵写出H的一种用途
⑶写出A受热分解的化学方程式
⑷若H与C反应固体增重4.2g,则参加反应的C气体在标准状况下的体积为 L
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右(写出最佳答案)
(1)沉淀的化学式:沉淀1 ,沉淀2 ,沉淀3 ;
(2)写出混合液+A的离子方程式 ;
溶液+B的离子方程式 。
已知A~O各代表一种物质,除O外其余物质均由短周期元素组成,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比 为2︰3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉 淀。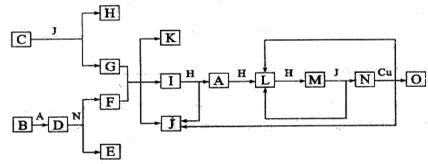
请回答下列问题:(1)组成B单质的元素位于周期表第 周期,第 族。化合物C和D的电子式为 ___ 、_____________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是 。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式: 。
写出G与F加热反应生成K、I和J的化学方程式: 。
(5)上图中在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有 个。