I.有关中和滴定的操作有: ①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
正确的操作顺序是 (填字母)
| A.⑤①②③④ | B.③⑤①②④ | C.⑤②③①④ | D.②①③⑤④ |
Ⅱ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+ = 2Mn2++5SO42-+3H2O
填空回答下列问题:
(1)不用 (填“酸式”或“碱式”)滴定管盛放高锰酸钾溶液。
(2)选何种指示剂 。(填序号)
①甲基橙 ②酚酞 ③ 石蕊 ④不用指示剂
(3)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则
(b-a)mL比实际消耗KMnO4溶液体积 (填“多”或“少”)。根据(b-a)mL计算得到的待测液浓度,比实际浓度 (填“大”或“小”)。
(4)无论是KMnO4溶液往NaHSO3溶液中滴,还是NaHSO3溶液往KMnO4溶液中滴,在其他操作正确规范的前提下,下列操作一定会使测定结果偏高的是 。(填序号)
①取用NaHSO3溶液的滴定管未用待测NaHSO3溶液润洗
②取用KMnO4酸性溶液的滴定管未用标准KMnO4酸性溶液润洗
③滴定过程中不慎有液体溅出
④滴定前仰视读数,滴定后平视读数
25℃时,①氢氟酸、②醋酸、③次氯酸的电离常数分别是3.5×10-4、1.8×10-5、3.0×10-8。请推测:它们的酸性由强到弱的顺序为______________________(填序号,下同),相同浓度的溶液中,氢离子浓度最大的是__________,电离程度最小的是_______;相同浓度的④氟化钠溶液、⑤醋酸钠溶液、⑥次氯酸钠溶液pH的从大到小顺序:_____________________________。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”) ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量YX2完全反应后,转移了 mol电子,则该反应的化学方程式为
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母) ,可以看到白色沉淀生成。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
I.有关中和滴定的操作有:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
正确的操作顺序是 (填字母)
| A.⑤①②③④ | B.③⑤①②④ | C.⑤②③①④ | D.②①③⑤④ |
Ⅱ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+= 2Mn2++5SO42-+3H2O
填空回答下列问题:
(1)不用 (填“酸式”或“碱式”)滴定管盛放高锰酸钾溶液。
(2)选何种指示剂 。(填序号)
①甲基橙 ②酚酞 ③石蕊 ④不用指示剂
(3)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则
(b-a)mL比实际消耗KMnO4溶液体积 (填“多”或“少”)。根据(b-a)mL计算得到的待测液浓度,比实际浓度 (填“大”或“小”)。
(4)无论是KMnO4溶液往NaHSO3溶液中滴,还是NaHSO3溶液往KMnO4溶液中滴,在其他操作正确规范的前提下,下列操作一定会使测定结果偏高的是 。(填序号)
①取用NaHSO3溶液的滴定管未用待测NaHSO3溶液润洗
②取用KMnO4酸性溶液的滴定管未用标准KMnO4酸性溶液润洗
③滴定过程中不慎有液体溅出
④滴定前仰视读数,滴定后平视读数
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:按下图装置进行实验。并回答以下问题。
①实验前先_______________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是 。
②实验中除称量样品质量外,还需称___________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯外还用到的玻璃仪器有_______________;
②实验中判断沉淀是否完全的方法是 。
③如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(计算结果保留两位有效数字)。
(8分)有一乡村中学由于条件有限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝或废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。(如图)
(1)哪个学生设计的装置比较合理? 。另一个装置不合理的原因(至少说出一个原因) 。
(2)用较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是 。
(3)还可以用哪些物品代替牙膏皮和稀硫酸完成制取氢气的实验?
。
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ =" _____" Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
据此,乙二酸分解的产物为______________________。上述装置中,D的作用是______。装置F中发生反应的化学方程式为: _________________________________________。
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_________________________________。
某学习小组从海带中提取I2,实验步骤如下:
(1)实验室焙烧海带,需要下列仪器中的____________
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三角架 f.酒精灯
(2)将所得海带灰加水溶解、过滤,所需玻璃仪器有_______________________________
(3)在滤液中检出了I-,还检出了K+,检验K+的操作步骤是_______________________。
(4)经查阅资料,得知氧化性由强到弱的顺序为:Cl2 > IO3- > H2O2 > I2,他们决定用H2O2做氧化剂氧化KI,而不用Cl2,原因可能是____________________________。
(5)小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈_______色;打开分液漏斗活塞,却未见液体流下,原因可能是___________。
(6)根据以下数据推测:
①已知SiCl4的沸点是57.6℃,则CCl4的沸点_________(填“高”或“低”)于57.6℃
②已知I2的沸点是113.6℃,熔点是185.2℃,从碘的CCl4溶液中分离出碘单质,应采取的方法是___________。
| A.过滤 | B.升华 | C.蒸发 | D.蒸馏 |
某课外活动小组为了验证铜与稀硝酸反应产生的气体是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹,F是装有一半空气的注射器。
17. 
18. 请回答有关问题:
19. (1)设计装置A的目的是 ,如何判断已完成该目的__________________
20. (2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ;B中反应的离子方程式为: 。
21. (3)装置E和F的作用是 ;为实现此作用,其操作方法是 。
22. (4)装置D的作用是 。
由图判断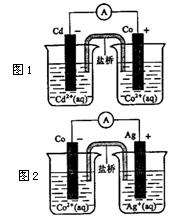
(1)Cd、Co、Ag三种金属的活泼性由强到弱的顺序是________________,
(2)有关盐桥的叙述正确的是_____________(可多选)
A 内盛含琼胶的饱和蔗糖溶液
B 内盛含琼胶的饱和氯化钾溶液
C 盐桥中的阴离子向负极区移动
D 可以用导线代替盐桥
(3)写出图1中正极反应方程式_____________________
写出图2中的总反应方程式_____________________
(4)反应一段时间后,__________(填“图1”、 “图2”)中的Co电极质量增加。
甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体。A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:
(1)用方程式解释A使湿润的红色石蕊试纸变蓝的原因___________________
(2)写出溶液C中加氯水的离子方程式___________________
(3)若A和B按1:1通入水中反应,写出反应方程式____________________________。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式: ____________。
(2)填写表中空格:(请在答题卡上填空)
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
|
|
| D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式: 。
(4)试管F中收集满气体后,下一步实验操作是: 。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。
(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 。8.4g铁粉参加反应,转移电子 mol。
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部应事先放置 ,其作用是 。
如图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。
(1)R为____(填“正”或“负”)极。
(2)A附近溶液的现象是_______,B附近发生的电极反应式为___ __。
(3)滤纸上的紫色点向哪方移动____(填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,C中的电极为_______(填“正”或“负”)极,电极反应式为_______________。
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)
△H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)
△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_________ _。
_。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)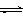 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),
分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间
后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图所示,则
上述CO2转化为甲醇的反应的△H3__________0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2
和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是__________(填
字母代号)。
| A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5 mol·L-1 |
| B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.该温度下,反应的平衡常数的值为3/16 |
E. 升高温度将使n(CH3OH)/n(CO2)减小
升高温度将使n(CH3OH)/n(CO2)减小
③甲醇燃料电池结构如下图所示。其工作时正极的电极反应式可表示为_______。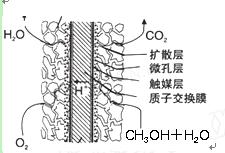
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为__________。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:__________;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)__________c(NO3-)+c(OH-)(填写“>”“=”或“<”)