某化学实验小组需用480 mL 0.5 mol/L的硫酸铜溶液,请回答下列问题:
(1)如果用胆矾(CuSO4·5H2O)来配制,需用胆矾的质量为________g。
(2)下面是配制硫酸铜溶液过程中的5个操作步骤:①向盛有胆矾的烧杯中加入20 mL蒸馏水使其溶解;②继续往容量瓶中加蒸馏水,至液面距刻度线1~2 cm处;③将烧杯中的溶液沿玻璃棒注入500 mL容量瓶中;④向烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2~3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;⑤改用胶头滴管加蒸馏水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。正确的操作顺序为__________________(填序号)。
(3)上述操作中,①、③都用到玻璃棒,其作用分别为________、________。
(4)下列操作会导致所配硫酸铜溶液物质的量浓度偏低的是________(填序号,下同);对所配溶液物质的量浓度无影响的是________。
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥
④所使用的容量瓶刚用某种浓度的硫酸铜溶液润洗过
⑤定容后,塞好瓶塞摇匀,装入用蒸馏水洗净的试剂瓶中
⑥没有洗涤溶解时所用的烧杯和玻璃棒
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。


I II
(1)写出下列仪器的名称:
a. b. c.
(2)仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 (填f或g)口通入 口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,反复颠倒摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为______________________;
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度线 ;若定容时俯视刻度线___________________。
(7)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理? 。
下图表示配制一定物质的量浓度溶液的几个关键实验步骤和操作,现欲配制230 mL 0.100 mol·L-1 Na2CO3溶液,回答下列问题:
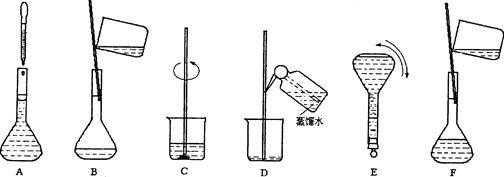
(1)若用Na2CO3.10H2O来配制溶液,需选择________的容量瓶,用天平称取晶体 克。若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度 (填偏大、偏小或无影响)。
(2)步骤B通常称为转移,玻璃棒的作用是 ______;步骤A通常称为 ,此时应注意视线与___________、___________水平相切,如果俯视刻度线,配制的浓度_____ (填偏大、偏小或无影响);步骤结束后发现液面低于刻度线,则配制的浓度 (填偏大、偏小或无影响)。
(3)将上述实验步骤A—F按实验过程先后次序排列 。
(4)下列关于容量瓶使用的说法正确的是
| A.使用前须干燥 |
| B.使用前先检查瓶塞不漏水 |
| C.配好的溶液可以贮存在容量瓶中 |
| D.热溶液须冷却至室温才能转移入容量瓶 |
E.容量瓶用于准确配制任意体积的一定物质的量浓度的溶液
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序是:E接 , 接 , 接 , 接F。
(2)气体发生装置中进行的反应化学方程式是 ;当0.5mol MnO2参与反应时,被氧化的HCl的质量为 ,生成的Cl2在标准状况下的体积约为 。
(3)在装置中:①饱和食盐水的作用是 ,②浓硫酸的作用是 。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是 ,写出反应方程式 。
(5)写出尾气吸收装置中进行的反应的化学方程式 。
下图所示装置是实验室常用的气体制取装置。据图回答下列问题:
(1)仪器a的名称____________,检查装置气密性操作为____________________。
(2)若实验室制取C2H2,a中盛放的药品为__________________;若制取氨气且a中盛放的药品为浓氨水,则b中盛放的固体药品为____________________;若需同时制取NH3和O2用于进行NH3的催化氧化实验,则b中所放的固体药品为________________。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
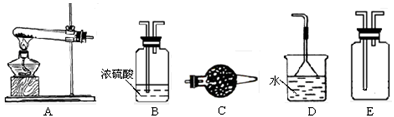
(1)实验空制取、收集干燥的NH3,需选用上述仪器装置中的 , 所用干燥剂的名称为 。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,写出制纳米级碳酸钙的化学方程式: 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级(1nm-100nm之间): 。
实验室用如图所示的仪器药品制取无水氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶水化合物FeCl3+6H2O=FeCl3•6H2O

(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序(①接_____,_____接_____,_____接_____;
(2)烧瓶A中反应方程式是 ,B中反应的化学方程式是_________。
(3)A、B中的酒精灯应先点燃 _ 处(填“A”或“B”(的酒精灯,理由是 _ 。
(4)这套实验装置是否完整? _ (填“是”或“否”(,若不完整还须补充 _ 装置(若第一问填“是”,则此问不需要作答(。
甲同学将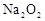 分别与H2O和浓盐酸反应,有如下现象:
分别与H2O和浓盐酸反应,有如下现象:
| 实验序号 |
使用药品 |
现象 |
| Ⅰ |
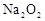 、 、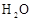 |
① 试管壁发热 ② 有无色无味气体产生 |
| Ⅱ |
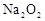 、浓盐酸 、浓盐酸 |
① 试管壁发热 ② 有刺激性气味的气体产生 ③ 反应后所得溶液呈浅黄绿色 |
请完成下列问题:
实验I中:
(1)该反应是_______________反应(填“放热”或“吸热”)。
(2)反应的化学方程式是__________________。
(3)证明无色无味气体是氧气的方法是 。
实验Ⅱ中:
(4)根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是 。
(5)若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验Ⅰ相同的气体,原因是__________。
现用质量分数为36.5%的浓盐酸(密度为1.19 g/cm3)配制1 mol/L的稀盐酸90 mL。
(1)实验中应选用的仪器是(填序号)____ ____;
①100 mL量筒 ②托盘天平(带砝码) ③玻璃棒 ④50 mL容量瓶
⑤10 mL量筒 ⑥50 mL烧杯 ⑦100 mL容量瓶 ⑧胶头滴管
(2)经计算,需量取浓盐酸的体积为________mL;
(3)此实验中玻璃棒的作用是____________________________;
(4)某学生实际配制稀盐酸的浓度,经滴定测量为0.98 mol/L,原因可能是下列操作中____ ____。
①取用完浓盐酸的量筒未洗涤
②转移溶液后,小烧杯未洗涤
③定容时俯视容量瓶刻度线
④移液前容量瓶内有少量蒸馏水
⑤定容摇匀后液面下降再加水
⑥定容时仰视容量瓶刻度线
实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如下图,1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm,3沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。请回答以下问题:

(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入 。
烧瓶内发生的反应的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中盛有10%的NaOH溶液,其作用是 。
(4)装置D中试管中装有液溴,实验开始后观察到的主要现象是 。
(5)开始反应时需向装置D中的烧杯里加入冰水,这是为了 。
(6)装置E的作用 。
实验室通常用右图所示的装置来制取氨气。回答下列问题:

(1)安装仪器时要求试管口略低于试管底的原因是
(2)加热后将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是
(3)除氨气外,还可以用该装置制取的常见气体有
欲用含有少量氯化钙的氯化钠固体,配制100 mLamol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
(1)称量粗盐样品mg,在托盘天平左盘上放__________________,右盘上放__________________。
(2)过滤时,漏斗下端管口应________,漏斗中液面应____________________________。
(3)蒸发操作时应将液体放在________中加热,等加热至________________________时停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是_______________,反应的化学方程式是_____________。
(5)在滤液中加入盐酸的作用是________________,反应的化学方程式是 ______________________。
(6)配制100 mLamol/L的NaCl溶液时,应从Wg固体中称取NaCl的质量为________,配制时应在____________________中进行定容。
实验室配制0.1 mol/L的BaCl2溶液可分两个阶段进行。
第一阶段:用托盘天平称取5.2 g无水BaCl2晶体。
第二阶段:溶解配制0.1 mol/L的BaCl2溶液。
第一阶段操作有如下几步:A.将游码拨至0.2 g处;B.将游码拨至“0”处;C.在天平两边的托盘上各放一张干净的等质量的滤纸,调节天平两边的螺母使天平平衡;D.取走药品,将砝码放回砝码盒内;E.往左盘内逐步添加晶体至天平平衡;F.在右盘上放置5 g砝码。(BaCl2相对分子量=208)
(1)其正确的操作顺序是(填序号):
B→______→______→A→______→______→______。
(2)第二阶段操作,应先将5.2 g BaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有____________、____________。然后将溶液转入_____________中,再经___________、_____________、_____________后即可得到0.1 mol/LBaCl2溶液。
(3)下列操作使配制的BaCl2溶液浓度偏低的有_________。
A.将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19 g/cm3配制成250mL 0.1mol·L-1的盐酸溶液。
(1)在图所示仪器中,配制上述溶液不需要的是 (填右图相应仪器的序号); 除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 ,其作用按使用的先后顺序分别是 和 。
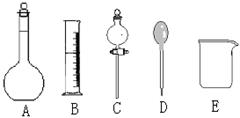
(2)根据计算,下列量程或规格中,本实验量筒应使用的是_______;
A、10mL B、100mL C、250mL D、500mL
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)
① 待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2 cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③ 在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)在容量瓶的使用方法中,下列操作正确的是 。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1 ~ 2cm处,用胶头滴管加蒸馏水至刻度线
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(5)假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1 mol/L)如何。(a、偏高;b、偏低;c、无影响,在下列横线上填相应序号)
①容量瓶中有少量蒸馏水
②烧杯和玻棒没有洗涤2-3次
③稀释浓HCl时,没有冷却就立即转移到容量瓶中
④配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
⑤若定容时俯视,所配溶液的物质的量浓度