(8分)根据下式所示的氧化还原反应设计一个原电池:Cu + 2Ag+ =Cu2+ + 2Ag
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图;
(2)注明原电池的正极和负极,以及外电路中电子流向;
(3)写出两个电极上的电极反应式;
下列框图中的A—J是中学化学中常见的八种物质,所有物质均由短周期元素组成,已知常温、常压下D为无色液体, C、E、G均为气体单质,B为金属,I是由3个原子组成的一元含氧弱酸分子, A—J可发生如下转化: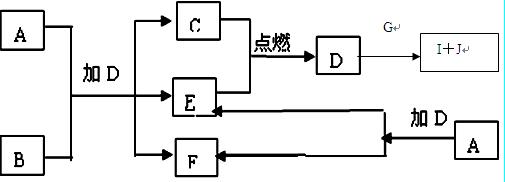
请填写下列空白:
⑴G的名称为 ,F的电子式为 。
⑵15.6gA与D完全反应,转移的电子的物质的量为 。
⑶常温下,A为一种 色的固体,它的一种重要用途是  。
。
⑷写出D、G反应转化为I和J的离子方 程式
程式  。
。
⑴某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是____;若反应过程中转移了0.3moL电子,则氧化产物的质量是__ g。
⑵将a mol Cl2 通入含b mol FeBr2的溶液中,
当0< a / b≤1/2 时,反应的离子方程式为: 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,
写出另2个可能发生的离子方程式:
① 当 a / b =1时,_______________________ ______;
② 当a / b≥3/2时,________________ _____________。
⑶观察如下反应,总结规律,然后完成下列问题:
① Al(OH)3 +H2O Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O NH4+ + OH_
NH4+ + OH_
Ⅰ.已知B(OH)3是一元弱酸,试写出其电离方程式________________________ __
Ⅱ.N2H4是二元弱碱,试写出其第二步电离方程式___________ _________________
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g.已知NaNO2能发生如下反应:aNO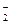 +xI—+yH+=bNO↑+cI2+zH2O,
+xI—+yH+=bNO↑+cI2+zH2O,
请回答下列问题:
(1)上述反应中,x、y、z的数值分别是 (全对才给分),
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为 .
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: .
(共12分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(2)上述反应中的还原剂是 ,为了防止大气污染,反应产生的气体可用 吸收。
(3)As2S3和HNO3有如下反应:As2S3+ 10H++ 10 NO-3 = 2H3AsO4+ 3S↓+10NO2↑+ 2H2O
若生成1mol NO2,则反应中转移的电子数为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.等于0.5 mol b.小于0.5 mol c.大于0.5mol d.无法确定
辉铜矿(主成份为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。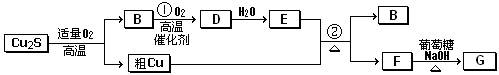
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式__________________________
______其中氧化剂为____________________。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯粗,在该电解反应中阳极物质是 ,电解质溶液是 ;
(4)自然界中当胆矾矿与黄铁矿(FeS2二硫化亚铁)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+ 5FeS2 +12H2O==7Cu2S+5FeSO4+12H2SO4
被氧化的硫和被还原的硫的质量比为_________________________;
将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
 CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CH4(g)+3/2O2(g) CO(g)+2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①该时间段内反应速率v(H2)= mol-1·L-1·min-1。
②比较此时正、逆反应速率的大小: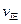
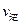 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是 。
在新型锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用G表示)的结构简式如下: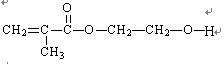
G的合成方法如下: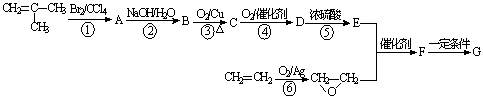
请回答下列问题:
(1)反应①、⑤的反应类型分别为_______,________。
(2)A的结构简式___________。
(3)写出含有-OH和-COOH的D的同分异构体任意2种:
_________________________,_______________________________。
(4)写出B→C反应方程式________________________________________。
(5)写出E→F反应方程式________________________________________。