(20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
① 甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
已知氧化性Fe3+>Cu2+>Fe2+。现有一包铁粉和铜粉混合粉末,某研究小组同学为了确定其组成,利用1.2mol/L的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
| 组别 |
|
|
|
|
| V[FeCl3(aq)]/mL |
50 |
50 |
50 |
50 |
| 混合粉末质量/g |
1.2 |
2.4 |
3.6. |
4.8 |
| 反应后剩余固体质量/g |
0 |
0.64 |
1.92 |
3.12 |
分析表中数据,下列结论正确的是
A.第①组反应后溶液中剩余c(Fe3+)=0.4mol/L B.第②、③组剩余固体全是铜
C.第④组的滤液中c(Fe2+)=2.0mol/L D.原混合粉末中n(Fe)∶n(Cu)=1∶2
1834年德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物得到苯。苯是重要的化工原料。结合所学知识完成下列各题。
(1)下列实验结论能够证明凯库勒式与苯的真实结构不相符的是 。
A.在一定条件下1mol苯能与3mol氢气发生加成反应
B.苯不能使酸性KMnO4溶液褪色
C.苯的邻二溴代物没有同分异构体
D.经测定苯为六边形结构,且所有碳碳键完全相同
(2)苯酚也是重要的化工原料,某实验小组以苯为原料制取苯酚,进而合成高分子化合物。请根据下列合成反应流程图填写A、B、C、D、可能的结构简式及①、②、③的反应条件。
A: B: C:
D: ①:
②: ③:
下列框图题中,已知A、E、F、H是单质,其中只有A是一种常见的金属单质,其它都是气体,且H是呈黄绿色;B是最常见液体,C是一种淡黄色粉末,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。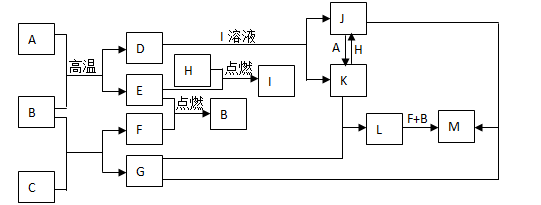
回答下列问题:
(1)写出C化学式: I的电子式 ;
(2)写出离子方程式:
K+H: ;
(3)写出化学方程式:
B+C: ;
W、X、Y、Z为原子序数依次增大的四种短周期主族元素。其中,W的一种原子核内没有中子,Y的原子最外层电子数是其内层电子数的3倍。Y与Z能形成两种常见的离子化合物Z2Y和Z2Y2。X与Y能形成两种化合物,其相对分子质量之比为7 : 11。请回答:
(1)Z在元素周期表中的位置是____。
(2)X、Z两元素原子的次外层电子数之比为____。
(3)由W与X两种元素组成的物质甲,其相对分子质量为28。甲可能发生的反应有____(填序号)。
①与氢气反应 ②与氧气反应 ③与水反应 ④与酸性高锰酸钾溶液反应
(4)由W、X、Y三种元素组成的有机物乙,相对分子质量为60。由W、X、Y、Z四种元素组成的无机物丙,相对分子质量为84,受热易分解。又知,乙与丙反应能放出气体,写出乙溶液与丙溶液反应的化学方程式:____。
(11分)铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题:
(1)沉淀物的化学式分别是:a ;d ;f 。
(2)溶液b中所含的金属阳离子是 ;溶液c中所含的酸根离子是 。
(3)加入的试剂A是 ,通入的气体B是 ,能否将B换成A?其理由是 。
(10分)将一定量的晶体A,隔绝空气加热到200OC时,全部分解为B、C、D、E四种气体,且其物质的量之比为2:1:l:1。这四种气体物质与其它物质的相互转化关系如下图所示。J是一种常见金属单质,C在固体时可用于人工降雨,D常温下是一种无色液体,F是一种可助燃的气体单质,固体K是具有磁性的黑色晶体。图中部分反应条件及生成物没有列出:
请按要求填空:
(1)C的分子式为 。
(2)写出L和B的水溶液反应的离子方程式 。
(3)写出K和盐酸溶液反应的离子方程式 。
1molK溶于足量I的稀溶液时,转移的电子数目为 。
(4)写出D与J反应的化学方程式 。
(5)A的化学式为 。
(14分)芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示: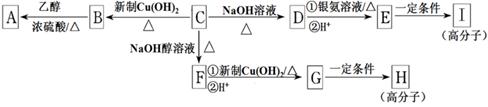
(1)C中含氧官能团的名称是 ;B→A的反应类型是 。
(2)H的结构简式是 。
(3)写出下列化学方程式:
① D与银氨溶液反应___________;② E→I 。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由_______________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中任意一种同分异构体的结构简式____________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: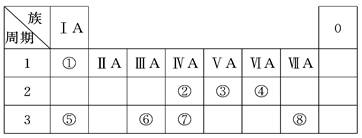
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5) W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
| 编号 |
性质 |
化学方程式 |
| 示例 |
氧化性 |
H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 |
|
|
| 2 |
|
|
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
【化学—有机化学基础】瘦肉精又名克伦特罗(4-氨基-α-叔丁胺甲基-3,5-二氯苯甲醇),是一种β2肾上腺素受体激动剂,临床上用于治疗哮喘。可由下图所示路线合成:
其中X表示某中间物质,请回答下列问题。
(1)判断反应④的反应类型 。
(2)书写反应③所代表的化学反应方程式:
。
(3)试推断中间物质X的结构简式: 。
(4)对氨基苯乙酮 的同分异构体有多种,请写出符合以下条件的其中任意一种
的同分异构体有多种,请写出符合以下条件的其中任意一种
a.苯环与氨基相连 b.与新制的Cu(OH)2悬浊液加热,有红色物质生成
c.苯环上有2个取代基
(5)①②③代表的整个反应过程完成了苯胺对位的酰基化,也完成了对 (填官能团名称)的保护,同时也避免了一些副反应的发生。
X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下:
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可做光导纤维。
按要求回答下列问题:
(1)C的化学式为 ;X的化学式为  。
。
(2)写出下列方程式
反应②的化学方程式  ;
;
反应⑦的离子方程式 。
一氧化碳是一种用途相当广泛的化工基础原料。
⑴利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)  Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
⑵金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下左图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
⑶下右图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。依次写出A、B两电极发生反应的电极反应式
__________________________________、___________________________________。

⑷已知:①CO(g)+2H2(g) CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=_______________。
CH3OCH3(g)+CO2(g)的△H=_______________。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工原料。某研究小组用粗铜(含杂质Fe) 按下述流程制备氯化铜晶体(CuCl2·2H2O)。
⑴实验室采用如右图所示的装置,可将粗铜与Cl2反应转化为固体
1(部分仪器和夹持装置已略去)。
①仪器A的名称是_________________。
②装置B中发生的反应的离子方程式是
__________________________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”)。
⑵试剂X用于调节pH以除去杂质,X可选用下列试剂中的_________(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
⑶在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色,小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=________________________,若增大氯离子浓度,K值_________(填“增大”、 “减小”或“不变”)。
②取氯化铜晶体配制蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是___________(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
.1914年从猫薄荷植物中分离出来的荆芥内酯可用作安眠药、抗痉挛药、退热药等。通过荆芥内酯的氢化反应可以得到二氢荆芥内酯,后者是有效的驱虫剂。二氢荆芥内酯的合成路线如下:
 A
A

 B
B 



⑴请写出A的结构简式_________________________。
⑵请写出生成B物质的化学方程式_____________________________________________。
⑶以上合成路线中发生取代反应的有_______步。
⑷ 含有的含氧官能团是_____________。
含有的含氧官能团是_____________。
⑸满足以下条件的 的同分异构体有__________种。
的同分异构体有__________种。
⑹请写出由CH2=CHCH2CHO合成 的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH
的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH CH2=CH2
CH2=CH2 Br-CH2CH2-Br
Br-CH2CH2-Br
海水中提取镁的工业流程如下图所示:
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。