已知CO(g)+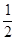 O2(g)=CO2(g),△H ="-283" kJ/mol;H2(g)+
O2(g)=CO2(g),△H ="-283" kJ/mol;H2(g)+ 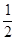 O2(g)=H2O(l),△H ="-285.8" kJ/mol;取CO和H2组成的混合气体0.5mol完全燃烧共放出142.34KJ的热量。若将此0.5mol混合气体充入密闭容器中置于900℃下发生 CO(g)+2 H2(g)
O2(g)=H2O(l),△H ="-285.8" kJ/mol;取CO和H2组成的混合气体0.5mol完全燃烧共放出142.34KJ的热量。若将此0.5mol混合气体充入密闭容器中置于900℃下发生 CO(g)+2 H2(g) CH3OH(g),在一定条件下达到平衡。平衡后容器内压强是相同条件下反应前压强的0.8倍,求:
CH3OH(g),在一定条件下达到平衡。平衡后容器内压强是相同条件下反应前压强的0.8倍,求:
(1)反应前混合气体中CO和H2的体积比;
(2)平衡混合气体中CH3OH和H2的物质的量;
(3)达到平衡时CO的转化率。
制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(1)CaCO3质量分数为0.90的石灰石100kg完成分解产生CO2 L(标准状况下)。
(2)石灰窑中,该石灰石100kg与焦炭混合焙烧,产生CO2 29120L(标准状况下),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
(3)已知粗盐水含MgCl2 6.80mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,然后加入Na2CO3除钙离子。处理上述粗盐水10m3,至少需要加Na2CO3 g。
(4)如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+。处理上述10m3粗盐水至少需要通入 L(标准状况下)碳酸化尾气。
将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:

(1)原合金中镁的质量为 ;
(2)盐酸的物质的量浓度为 。
将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀,当加入400mL NaOH溶液时沉淀量恰好达到最大。请求
(1)所用盐酸的物质的量浓度为多少mol/L
(2)生成的沉淀的质量最大值是多少g?
(3)原合金中Mg的质量百分含量(计算结果保留一位小数点)。
用14.2g无水Na2SO4配制成500mL溶液,其物质的量浓度为多少?若从中取出10mL,加水稀释到100mL,求稀释后Na2SO4的物质的量浓度为多少?
(1) 在标准状况下,由CO和CO2组成的混合气体13.44 L,质量为20 g,该混合气体中,碳与氧两种原子的数目之比为________。
(2)在____ _ mL 0.2 mol/L NaOH溶液中含1 g溶质;
(3)需要480 mL 0.2 mol/L CuSO4溶液做实验,需要称取CuSO4·5H2O________g来配溶液。
(4)在质量分数为28%的KOH水溶液中,OH-与H2O分子数之比是________。
(5)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl-的物质的量为____ mol
6.32g的KMnO4与过量的浓盐酸完全反应,化学方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,回答下列问题:
(1)用双线桥标出反应中电子转移的方向和数目并指出反应中的氧化剂、还原剂。
(2)产生的Cl2在标准状况下的体积是多少?
(3)被氧化的HCl的物质的量是多少?
(1)4.8gO2和0.2molCO2,质量之比是 ,在同温同压下的体积之比是 .相同物质的量的SO2和SO3,所含分子的数目之比为 ,所含O原子的物质的量之比为 .
(2)在标准状况下,将224LHCl气体溶于635mL水(ρ=1.0g·cm—3)中,所得盐酸的密度为1.18 g·cm—3。试计算:
①所得盐酸的物质的量浓度为 。
②取出这种盐酸100mL,稀释至1.18L,所得稀盐酸的物质的量浓度为 。
③现用0.1 mol·L-1的NaOH溶液中和②中盐酸100mL,需要NaOH溶液体积为 。
室温下,将100mL某盐酸和硫酸的混合溶液分成两等分。一份加入过量BaCl2溶液,充分反应后得沉淀2.33g;另一份加入50mL1.0mol·L-1NaOH溶液,充分反应后溶液的 c(OH-)=0.1mol·L-1(反应后溶液的体积为100mL)。试计算:
(1)每份溶液中所含H2SO4的物质的量______________mol。
(2)原混合溶液中盐酸的物质的量浓度_____________mol·L-1
计算:常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。计算:
(1)求该混合溶液中NaCl的质量分数。
(2)求该混合溶液中NaCl的物质的量浓度。
(3)求在1 000 g水中需加几摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)
下图是“康师傅”牌饮用矿泉水的标签的部分内容。请认真阅读标签内容,计算:

(1)镁离子的物质的量浓度的最大值是 。
(2)一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过 mol
(1) 12.4g Na2R中含Na+0.4mol,则Na2R的摩尔质量为 。
(2)有相同状况下的两种气体12C18O和14N2。若两种气体的质量相等,则12C18O和14N2气体所含质子数之比为 ;若两种气体的分子数相同,则12C18O和14N2的体积之比为 。
常温下,在27.9g水中溶解12.1g Cu(NO3)2·3H2O,恰好达到饱和,设该溶液密度为1.20g /cm3,求:
(1)该溶液中Cu(NO3)2的物质的量浓度。
(2)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?若要使稀释后溶液中的Cu2+全部转化为单质铜,需要加入铁粉多少克?
(1)5.3g Na2CO3的物质的量为____________,将其配成500mL溶液,所得溶液中Na2CO3的物质的量浓度为____________。取出该溶液10mL,在取出的溶液中通入HCl气体到不再产生气泡为止,共消耗____________mL HCl气体(标准状况)。
(2)V mL Al2(SO4)3溶液中,含有Al 3+ m g,则溶液中SO42-的物质的量浓度为_______。(用含有m、V的式子表示)