某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为
(2)两同学利用右图所示装置进行测定
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同) 。若未进行步骤 ,将使测量结果偏低。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 。
(3)丙同学认为还可以通过测量CO2的体积或测量 来测定沉淀中CuCO3的质量分数。
(8分)为了探究铁与氯气反应制取氯化铁的实验,某同学甲设计了如下的实验方案。其实验装置如下图,加热装置省略。已知:氯化铁易溶于水,熔、沸点低,受热易变为气态,而遇冷又易变为固态。
(1) 试管B中的现象是___________________,
试管B中的现象是___________________,
反应的离子方程式:____________________________ _。
(2)试管C中氢氧化钠溶液的作用___________________________________。
(3)某同学乙猜测铁与氯气反应可能还会生成氯化亚铁,为了探究生成物中是否含有氯化亚铁(假设铁已完全反应),请你设计实验方案
(4)氯化铁易溶于水,熔、沸点低,受热易变为气态,而遇冷又易变为固态,故认为甲同学上述实验装置有缺陷。你认为丙同学判断的依据是: 。
(14分,每空2分)某化学兴趣小组为了探究:在常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1: ;猜想2 ;猜想3 。
为了验证猜测,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入, :
(1)B中应该装下列 试剂(填编号);
| A.NaCl溶液 | B.KMnO4溶液 | C.盐酸 | D.澄清石灰水 |
(2)A中品红的作用是: ;
(3)D中澄清石灰水的作用是: 。
通过该实验,小组同学观察到以下三个实验现象:
①A中品红褪色 ②C中品红不褪色 ③D中澄清石灰水变浑浊
【得出结论】
由上述现象小组同学确认该气体的成分是 。
已知HI是一种无色,有刺激性气味,极易溶于水的气体,HI的水溶液称之为氢碘酸,是一种强酸。
(1)请写出I元素在周期表的位置:第五周期 族
(2)将HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能有 气体。
(3) 小明拟对HI通入浓硫酸后的混合气体成分进行验证和探究。他设计了如下实验装置图
初步探究设计:
①其中直形玻璃管中所装的药品是 (写名称)
②足量四氯化碳的两个作用是:  。
。
进一步探究:
查阅资料:氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2。
③小明拟对溶在水层的其它混合气体成分做进一步探究。请你从以下限选试剂中选择合适的试剂帮小明完成实验报告。
限选的试剂:石蕊试剂、品红溶液、酸性KMnO4溶液、0.1mol/L HNO3、淀粉溶液、BaCl2溶液
| 实验方案 |
可能的现象和相应的结论 |
| 取少量烧杯中的上层溶液分装入A、B两支试管中 |
|
| |
|
| |
|
为定性探究乙醇的性质,某化学课外小组通过查阅资料并设计了实验方案进行探究。
方案Ⅰ:在盛有少量无水乙醇的试管中,加入一粒除去煤油的金属钠,在试管口迅速塞上配有尖嘴导管的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上,在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊产生。
(1)请写出乙醇与钠反应的化学方程式: ▲ 。
(2)以上实验设计因缺少必要的步骤而存在安全隐患,请你指出所缺少必要的步骤是
▲ 。
(3)若向烧杯中加入少量澄清石灰水后发现有混浊,则燃烧产生CO2的物质最可能是
▲ (写名称)。
方案Ⅱ:(1)取一根铜丝,把其中一端绕成螺旋状(增大接触面积)。点燃一盏酒精灯,把绕成螺旋状一端的铜丝移到酒精灯外焰上灼烧(如右图1),观察到的实验现象: ▲ 。
(2)把螺旋状铜丝往酒精灯内焰移动,观察到的实验现象: ▲ ,用化学方程式表示该现象产生的原理: ▲ 。
镁能在二氧化碳中燃烧:2Mg+CO22MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如下装置进行探究。
请回答下列问题:
(1)装置a的作用是 ,仪器A的名称 。
(2)装置b的作用是 ,装置c中应盛放 。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是 。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。将滤纸上的黑色物质移入小试管中,加少量浓硫酸,加热有刺激性气味的气体生成。则该黑色物质与浓硫酸共热的化学反应方程式为 。
(5)往(4)所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式: 。
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ;
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E、Fe2(SO4)3 |
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
如图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。
(1)R为____(填“正”或“负”)极。
(2)A附近溶液的现象是_______,B附近发生的电极反应式为___ __。
(3)滤纸上的紫色点向哪方移动____(填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,C中的电极为_______(填“正”或“负”)极,电极反应式为_______________。
有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
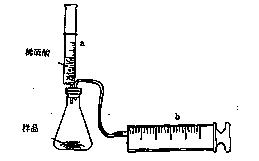 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
| |
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
| m(混合物) |
9.2g |
15.7g |
27.6g |
| V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下: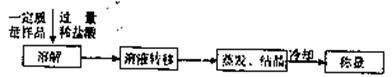
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。