已知KMnO4和H2C2O4在酸性溶液中发生反应:
KMnO4+ H2C2O4+ H2SO4— K2SO4+ MnSO4+ CO2↑+ H2O(请配平)。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。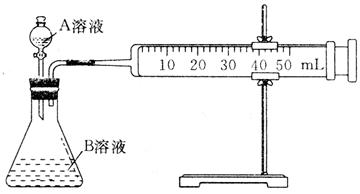
实验时A溶液一次性放下,A,B的成分见下表:
| 序号 |
A溶液 |
B溶液 |
| ① |
2mL 0.1 mol·L-1 H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液 |
| ② |
2mL 0.2 mol·L-1 H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ |
2mL 0.2 mol·L-1L H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速 率的大小。取两支试管各加入2
率的大小。取两支试管各加入2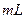 0.1
0.1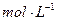 H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4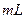 0.1
0.1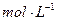 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了右图的实验装置(夹持仪器已略去)。进行了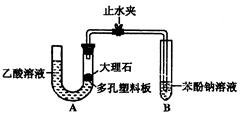
下述一些实验:
(1)某生检查装置A的气密性时,先关闭止水
夹,从左管向U型管内加水,至左管液面高于右
管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好。你认为该学生的操作正确与否? (填“正确”或“错误”)
(2)大理石与乙酸溶液反应的化学方程式为
(3)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ,反应的离子方程式为 。
(4)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,他的理由是 。改进该装置的方法是 。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。试填空。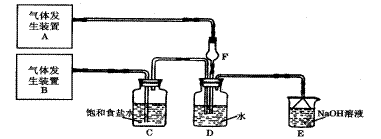
(1)D装置中主要反应的离子方程式为 ,
F仪器的作用是: 。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液 b 氯化亚铁溶液 c硫氰化钾溶液
d 苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液
①若Cl2过量:取适量D中溶液滴加至盛有 (选填一个符号)试剂的试管内,再加入 _ (选填一个符号)试剂,发生的现象是: ;
② 若选用上述试剂中的一种结合必要的操作就可以验证通入C装置中气体是Cl2过量还是SO2过量,该试剂是_________。(选填一个符号)
必要操作和结论______________________________ ________。
某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
| 实验 序号 |
A |
B |
烧杯中的液体 |
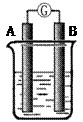 灵敏电流计指 灵敏电流计指针是否偏转 |
| 1 |
Zn |
Cu |
稀硫酸 |
有 |
| 2 |
Zn |
Cu |
乙醇 |
无 |
| 3 |
Cu |
C |
氯化钠溶液 |
有 |
| 4 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验1中电流由 极流向 极(填“A”或“B”)
(2)实验4中电子由B极 流向A极 ,表明负极是 电极(填“镁”或“铝”)
(3)实验3 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
| 饱和石灰水与水的体积比 |
1:0 |
1:1 |
1:2 |
1:3 |
1:5 |
1:7 |
| 能生成CaCO3的最大量(g/100水) |
A |
0.110 |
0.073 |
0.055 |
0.037 |
0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
| 热力学温度/K |
282 |
298 |
308 |
| CaCO3溶解度(g/100水) |
0.130 |
0.094 |
0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
| P(CO2)/Pa |
0 |
1.40×104 |
9.95×104 |
| CaCO3溶解度(g/100水) |
0.001 3 |
0.023 3 |
0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是:
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象;
乙:① 用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/25 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有 
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
E.稀释后A溶液中水的电离程度比B溶液中水的电离程度小
某课外活动小组进行下列实验(如下图所示)。
(1)某同学将这些实验分成三组,各组的试管编号是:第一组①②;第二组③④⑤⑥;第三组⑦⑧。
你认为如此分组的依据是: 。
(2)写出试管②⑤⑧的实验现象及有关的离子方程式:
② ; 。
⑤ ; 。
⑧ ; 。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 、
、 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的微粒是:______ (填粒子的化学式,下同);
乙同学认为这是发生化学反应所致,则使溶液呈黄色的微粒是_________。
(2)如果要验证乙同学判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 E.硝酸银溶液 F.碘化钾淀粉溶液 |
| 实验方案 |
所选用试剂(填代号) |
实验现象 |
| 方案一 |
|
|
| 方案二 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是 ,相应的离 子方程式为 ;
子方程式为 ;
有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下:
 (1)实验时,导管接口的顺序是 。
(1)实验时,导管接口的顺序是 。
(2)装置①内发生反应的化学方程式是 (任写一个,并标出电子转移方向和数目)。
(3)证明混合气体中含有氢气的实验现象是  。(4)证明混合气体中含有CO的实验现象是 。
。(4)证明混合气体中含有CO的实验现象是 。
全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时入放A、B、C三支试管中进行研究。
(1)请你帮助该学生完成下列实验设计的内容:
| 编号 |
操作方法 |
实验目的 |
| A |
|
探究铁在干燥空气中的生锈情况 |
| B |
放入铁钉,注入蒸馏水浸没铁钉并用植物油液封 |
|
| C |
|
探究铁在有空气和水时的生锈情况 |
(2)一周后,编号为________的试管中的铁钉最易生锈。证明铁生锈的条件是: 。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在新疆吐鲁番比安装在昆明滇池海埂大坝 (填“更易”或“更难”)生锈。
(13 分)有一包固体粉末,由CaCO3、Na2SO4、KCl、Ba (NO3)2、CuSO4中的三种物质组成,取样品进行如下实验:
(1)写出实验过程中发生反应的化学方程式: 。
(2)固体粉末中一定不存在的物质是 ;一定存在的物质是 ;
(3)将固体粉末可能的组合填入下表:(可以不填满,也可以再补充。)
| 序号 |
化学式 |
| Ⅰ |
|
| Ⅱ |
|
| Ⅲ |
|
(4)请设计一个实验进一步确定混合物的组成,简述实验步骤、现象和结论。
(26分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
|
|
(2)实验①中CO2质量随时间变化的关系见下图:
请在图中画出实验②和④中CO2质量随时间变化关系的预期结果示意图。
Fe2O3和Cu2O都是砖红色粉末,课外小组通过实验探究某砖红色粉末是Fe2O3、Cu2O或者是二者混合物。探究过程如下:
查阅资料:Cu2O是碱性氧化物,Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末为Fe2O3、Cu2O的混合物
设计探究实验
取少量粉末,向其加入足量稀盐酸在所得溶液中滴加苯酚溶液
(1)若假设1成立,则实验现象是 。
(2)若滴加苯酚后溶液不变紫色,则证明原固体粉末不含Fe2O3。你认为结论是否合理 (填“合理”或“不合理”),简述理由 。
(3)若固体粉末完全溶解无固体存在,滴加苯酚时溶液不变紫色,证明原固体粉末是 ,相关的离子方程式为 。(任写其中一个)
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。如果要探 究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度 / mol·L-1 |
溶液褪色所需时间 t / min |
||
| 第1次 |
第2次 |
第3次 |
|
| 0.01 |
14 |
13 |
11 |
| 0.001 |
6 |
7 |
7 |
①计算用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化)。
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案: