如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
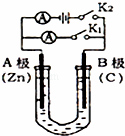
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A 极,A极的电极反应式为 .若所盛溶液为KCl溶液:则B极的电极反应式为 .
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”)。
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措。
(1)研究发现利用NH3可消除硝酸尾气中的NO污染。NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示:
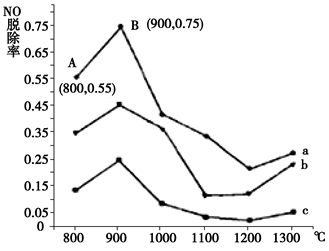
①用化学反应方程式表示NH3消除NO的反应原理 (不用注明反应条件)。
②曲线b 对应NH3与NO的物质的量之比是 。
③曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为____ mg/(m3·s)。
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3,若吸收的溶液中N的浓度为ag·L- 1,要使1m3该溶液中的完全转化为,至少需通入标准状况下的O2 L。(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4。
①NaHSO3溶液中离子浓度大小为 。
②写出生成S2的电极反应式 。
按下图所示装置进行实验,并回答下列问题:
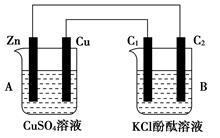
(1)判断装置的名称:A池为 ,B池为 。
(2)锌极为____极,电极反应式为 ;铜极电极反应式为 ;石墨棒C1为____极,电极反应式为 ;石墨棒C2附近的实验现象为___ _____。
(3)当C2极析出224 mL气体(标准状况下)时,锌质量 (填增加或减少),为 g;CuSO4溶液的质量 (填增加或减少),为 g。
如图所示装置,回答下列问题:

a、b、c、e、f均为石墨电极,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液和足量含有酚酞的K2SO4溶液.
(1)通电进行电解,发现丙中f极先变红色。
①直流电源的M极是 (填“正极”或“负极”)
②请写出甲池a 电极上的电极反应式:
③甲池电解过程中溶液的pH (填“增大”或“减小”),原因是:
④如果导线中通过4mol电子,则丙中溶液质量 (填“增大”或“减小”) g
(2)若用丙装置在铁上镀铜,需要将丙装置进行改装,则e应该是 (填“铁”或“铜”),电镀液是 溶液,电镀过程中电镀液的浓度 (填“增大”、“减小”或“不变”)。
(3)若用丙装置对铁的腐蚀进行防护, (填e或f)为铁电极,该防护方法称为__________。
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空:

(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________________
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_____ (选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却、________(填写操作名称)除去NaCl。
(6)在电解过程中,发生总反应的化学方程式为__________________
(7)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,请写出Cl2和NaOH溶液反应的化学方程式__________。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为 。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填>、<或=)。
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。

写出石墨Ⅰ电极上发生反应的电极反应式 ,N2O5在电解池的 区生成(填“阳极”或“阴极”)。
【化学—选修2:化学与技术】(15 分)氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图1 所示:

(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制, 写出一次精制中发生的离子方程式 、 ,若食盐水不经过二次精制,仍会有少量的Ca2+、Mg2+直接进入离子膜电解槽,这样产生什么后果是 。
(3)图2 是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B 处产生的气体是 ,E电极的名称是 极。电解总反应的化学方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的离子方程式为 。
(5)已知在电解槽中,每小时通过1 安培的直流电理论上可以产生1.492 g 的烧碱,某工厂用300 个电解槽串联生产8 小时,制得30%的烧碱溶液(密度为1.342 吨/m3)113 m3,电解槽的电流强度1.45×104 A,该电解槽的电解效率为______ 。
有电化学装置如图连接,请回答下列问题: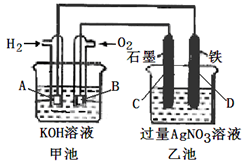
(1)图中甲、乙两池的名称:甲池是 装置;乙池是 装置。
(2)请回答下列电极的名称:通入H2的电极名称是 ,C(石墨)电极的名称是 。
(3)写出电极反应式:通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗H2 mL(标准状况下)。
某化学兴趣小组设计了下图所示实验装置,其中c为石墨电极,d为银电极。
(1)甲池中OH-移向 极(填电极的字母序号),f为 (填电极名称)。
(2)a极上的电极反应式是 。
(3)乙池中放出气体的电极为 极(填“c”或“d”),写出此电极反应式: 。
(4)乙池中总反应的离子方程式是 。
(5)当乙池中阴极质量增加5.40 g时,丙池某电极析出1.60 g金属,则丙池的溶液中溶质可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
根据下图所示回答有关问题:
(1)甲池为 (选填“原电池”或“电解池”),石墨A上发生的电极反应式为: 。
(2)乙池中Zn棒为 极, Zn棒上发生反应的电极反应式为: 。
(3)石墨B上刚好有9.6克物质析出时,则反应过程中转移的电子数为 。
塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为 CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
① ;② 。
(2)设通过0.01mol电子后,阴极上沉积出铜 0.2879g , 阴极上还可能放出的气体是 。计算标准状况下阴阳极共放出气体的体积 。
从H+、K+、Cu2+、Cl-、SO42-中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
(1)以碳棒为电极进行电解,电解质的物质的量减少,水的物质的量保持不变,两极都有气体生成,气体体积相同,则该电解质的化学式为____________,电解的阴极反应_________,电解的阳极反应_____________,电解的总方程式是______________。
(2)以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,则该电解质的化学式为____________________,阴极反应式为____________________,阳极反应式为___________________________。
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,则电解质的化学式为____________,电解的总方程式为__________________________________。
某化学小组用下图装置电解CuCl2溶液制少量漂白液:
(1)其阳极的反应式是: ;导气管W端应与出气口 连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
| 物质名称及化学式 |
氯化亚铜CuCl |
碱式氯化铜Cu2(OH)3Cl |
| 性质 |
白色固体、不溶水 |
绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有Cu或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,进行实验。
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是 ,无水硫酸铜的作用是 ;
②d中反应的离子方程式是 ;
③装置b中发生反应的化学方程式是 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为 。
⑤阴极上产生白色物质的物质的量是 ;若装置b冷却时不继续通H2,则计算所得CuCl的产率会 (偏大、偏小、不变)。
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH 7(填“>”、 “<” 或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2 mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。