关于下列装置的说法正确的是

① ②
| A.①中盐桥内的K+移向CuSO4溶液 |
| B.①将电能转变为化学能 |
| C.若②用于铁棒镀铜,则N极为铁棒 |
| D.若②用于电解精炼铜,溶液中的Cu2+浓度保持不变 |
(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) =" CO(g)" + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) =" NaC1(aq)" + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式___________。
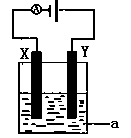
(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
③若用此电解装置模拟工业精炼铜,则应将a改为 溶液,并将 极换成粗铜(填“X”或“Y”)
镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
如果利用该电池精炼铜,则粗铜应连接的极是
| A.NiOOH | B.Ni(OH)2 | C.Cd | D.Cd(OH)2 |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.当电池负极消耗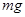 气体时,电解池阴极有 气体时,电解池阴极有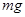 气体生成 气体生成 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
C.电解后,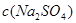 不变,且溶液中有晶体析出 不变,且溶液中有晶体析出 |
D.电池中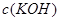 不变;电解池中溶液 不变;电解池中溶液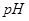 变大 变大 |
有关下列装置的叙述不正确的是( )
① ②
② ③
③ ④
④
| A.图①铝片发生的电极反应式是:Al+4OH--3e-=AlO2-+2H2O |
| B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+=Fe2++H2↑ |
| C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.图④充电时,阳极反应是:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
某同学设计了一种电解法制取Fe(OH)2的实验装置(如右图)。玻璃管内的电解液为NaCl溶液, 通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:

(1)写出A电极的电极反应式 ;B电极的电极反应式 ;
(2)若电解改用NaOH溶液作电解液,发现电解一开始即出现灰绿色沉淀,该沉淀产生在 极附近(选填“A”或“B”)。试分析为什么用NaCl溶液作电解液时白色沉淀能保持较长时间的原因: 。
【化学——选修2:化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到10000C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是 , 反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 ; ;

(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
将含有0.400molCuSO4和0.200molFeCl3的水溶液1L,用惰性电极电解一段时间后,在一个电极上析出19.2gCu,此时在另一电极上放出的气体在标准状况下的体积为
| A.5.60L | B.6.72L | C.4.48L | D.7.84L |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
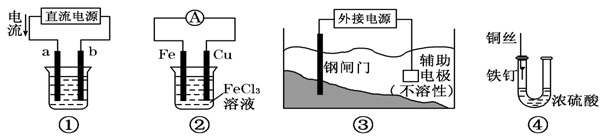
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.HCl、CuCl2、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
| A.1.12L | B.2.24 L | C.3.36 L | D.4.48L |
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是
| |
电解质溶液 |
阳极 |
阴极 |
加入的物质 |
| A |
NaCl溶液 |
碳 |
铁 |
盐酸 |
| B |
稀硫酸 |
铜 |
碳 |
水 |
| C |
硫酸铜溶液 |
铜 |
碳 |
硫酸铜 |
| D |
NaOH溶液 |
碳 |
铁 |
水 |
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,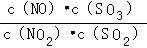 的值及SO2转化率不变 的值及SO2转化率不变 |
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。