将含0.4 mol/LCu(NO3)2和0.4 mol/L KCl的水溶液500 mL,用惰性电极电解一段时间后,在一个电极上析出0.15 mol Cu,此时在另一电极上放出气体,在标准状况下约为( )
| A.5.6 L | B.6.72 L | C.2.8 L | D.8.4 L |
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a:X、Y是两块电极板,通过导线与直流电源相连。请回答下列问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______________,在X极附近观察到的现象是_____________。
②Y电极上的电极反应式为_______________,检测该电极反应产物的方法是_______________;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是______,电极反应式是_______________;
②Y电极的材料是______,电极反应式是_______________;(说明:杂质发生的电极反应不必写出)
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )

|   |
a极板 |
b极板 |
X电极 |
Z |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
 
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间。假设在电解过程中产生的气体全部逸出,下列说法正确的是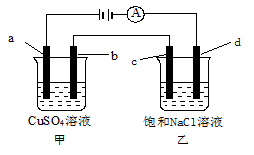
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.甲烧杯中a电极反应式为:4OH--4e-===O2↑+2H2O |
下列叙述正确的是( )
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
| C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-=2H2O |
| D.工业冶炼金属铝的方法是电解熔融的氯化铝 |
下列关于铜电极的叙述中,正确的是( )
| A.电解稀硫酸制H2、O2时铜作阳极 |
| B.用电解法精炼粗铜时粗铜作阴极 |
| C.在镀件上电镀铜时用金属铜作阴极 |
| D.铜锌原电池中铜是正极 |
某同学组装了图所示的电化学装置,其中电极Ⅰ为Al,其它均为Cu,下列说法正确的是
| A.装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池 |
| B.盐桥中电子从右侧流向左侧 |
| C.电极Ⅱ逐渐溶解 |
| D.电极IV的电极反应:Cu2+ + 2e- = Cu |
下列实验能达到预期目的的是( )
| A.滴定管洗净后,直接注入标准液进行滴定 |
| B.用石墨作电极,电解Mg(NO3)2和Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱 |
| C.称取19.0g氯化亚锡(SnC12),用蒸馏水溶解,定容至100mL,配制1.0mol/L SnC12溶液 |
| D.测定NaC1和NaF溶液的pH,确定F、C1两元素非金属性的强弱 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
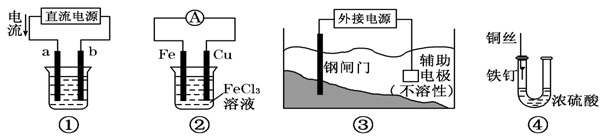
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.HCl、CuCl2、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
| A.1.12L | B.2.24 L | C.3.36 L | D.4.48L |
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是
| |
电解质溶液 |
阳极 |
阴极 |
加入的物质 |
| A |
NaCl溶液 |
碳 |
铁 |
盐酸 |
| B |
稀硫酸 |
铜 |
碳 |
水 |
| C |
硫酸铜溶液 |
铜 |
碳 |
硫酸铜 |
| D |
NaOH溶液 |
碳 |
铁 |
水 |
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,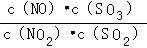 的值及SO2转化率不变 的值及SO2转化率不变 |
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。