(一) A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/l。反应进行2min后A的浓度为0.8mol/l, B的浓度为0.6mol/l, C的浓度为0.6mol/l。则2min内反应的平均速率为v(A)= ,v (B) = ,v(C)= 。该反应的化学反应方程式为: 。
(二) 比较下列各组热化学方程式中的ΔH的大小关系。
(1)已知1 mol白磷转化成红磷,放出18.39 kJ的热量,又知:①P4 (白,s)+5O2(g)=2P2O5(s) ΔH1,
②4P(红,s)+5O2(g)=2P2O5(s) ΔH2。
则ΔH1和ΔH2的关系:ΔH1 ΔH2
(2)③ S(g)+O2(g)==SO2(g) △H1
④S(s)+O2(g)==SO2(g) △H2 ΔH1 ΔH2
(3)已知:高温下,在密闭容器中用H2还原WO2可得到金属钨。当温度过高时,WO2(s)会转变为WO2 (g)。请根据以下反应:
⑤WO2 (s) + 2H2 (g) 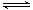 W (s) + 2H2O (g) ΔH = +66.0 kJ· mol-1
W (s) + 2H2O (g) ΔH = +66.0 kJ· mol-1
⑥WO2 (g) + 2H2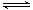 W (s) + 2H2O (g) ΔH = -137.9 kJ· mol-1
W (s) + 2H2O (g) ΔH = -137.9 kJ· mol-1
计算出WO2 (s) 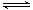 WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g) 2NO2(g)
2NO2(g)

(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。
①A点的逆反应速率v逆 (O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些
NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
| A.容器内气体颜色不再变化 |
| B.v正(NO)="2" v正(O2) |
| C.气体平均摩尔质量在此条件下达到最大 |
| D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g)△H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO+2CO 2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
① T1_(填“>”“<”或“=”)T2。
② 在T2温度下,0~2s内的平均反应速率v(N2)=________。
(2)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。通入O2的一极为_______(填“正极”或“负极”),该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为_________。
将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 3A(g)+B(g) xC(g)+2D(g),经过5min后测得D的浓度为0.5 mol/L,c(A)∶c(B)=3:5,C的反应速率是0.1mol/(L·min)。
xC(g)+2D(g),经过5min后测得D的浓度为0.5 mol/L,c(A)∶c(B)=3:5,C的反应速率是0.1mol/(L·min)。
(1)x的值是 ;
(2)A在5min末的浓度是___________;
(3)B的平均反应速率是______ __,A的转化率是_______________。
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g) 2C(g);△H =QkJ/mol
2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0. 50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= 实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是

a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的  。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的  。
。
①a、b、c必须满足的关系是 (一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为_____;2s时物质B的浓度为__________;
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为__________;若再通入少量B气体,体系中A的物质的量_________(填“增大”、“减小”或“不变”),若要使A的物质的量再达到与原平衡状态相同,可采取的三种措施有 、 、
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) 2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
(1)0~10s内A的平均反应速率为 。
(2)反应达平衡时B在平衡混合气体中的体积分数为 。
(3)平衡后,其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.在隔热条件下,体系的温度不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气 B.使用催化剂
C.升高温度 D.再充入1molA和1.5molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),整个过程中物质B的转化率为 。
将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 3A(g)+B(g) xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。
xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。
在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则

(1)、该反应的化学方程式为: ;
(2)、t1 s时反应物A的转化率为: ;
(3)、0~t1 s内A的反应速率为v(A)= ;
某密闭容器中,有A、B两种气体,反应按下式进行A(g)+B(g)=2C(g)反应经过2s后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75 mol/L,c(C)=0.5 mol/L。
(1)B物质的起始浓度各为
(2)2s时A的转化率
(3)用物质A表示反应的平均速率
(本小题满分14分)
T1温度下,体积为 2L的恒容密闭容器,加入4.00mol X,2.00mol Y,发生化学反应 2X(g)+Y(g)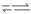 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。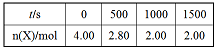
(1)前500s反应速率v(M)= _____________,该反应的平衡常数K=_____________。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________(填序号)
A.X的消耗速率与M的消耗速率相等
B.混合气体的平均相对分子质量不变
C.v(Y)与v(M)的比值不变
D.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____________。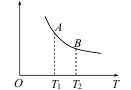
A.Y的逆反应速率
B.M的体积分数
C.混合气体的平均相对分子质量
D.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____________1.5mol/L(填“>”、“=”或“<”),理由是__________________。
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化关系曲线如图所示。
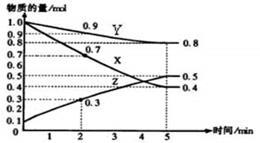
(1)由图中的数据分析,该反应的化学方程式为 ___________
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (填写“大、小或相等”)。
(10分,每空2分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,不正确的 (选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:

(1)该反应的化学方程式为______
(2)反应开始至2min,用Z表示的平均反应速率为______
自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g) 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) |
0 |
10 |
20 |
25 |
30 |
| 条件A [n(NO2)](mol) |
0.20 |
0.14 |
0.13 |
0.13 |
0.13 |
| 条件B [n(NO2)](mol) |
0.20 |
0.10 |
0.10 |
0.10 |
0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。