在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是( )
| A.0.1 mol·L-1·min-1 | B.0.3 mol·L-1·min-1 |
| C.0.2 mol·L-1·min-1 | D.0.6 mol·L-1·min-1 |
可逆反应A+3B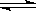 2C+2D,在四种不同的情况下的反应速率分别为:
2C+2D,在四种不同的情况下的反应速率分别为:
① νA=0.15 mol/(L·s) ②υB=0.6 mol/(L·s)
③ υC=0.4 mol/(L·s) ④υD=0.45 mol/(L·s)。
该反应进行最快的是( )
| A.① | B.②和③ | C.④ | D.①和④ |
反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.4" mol ·L-1·s-1 B.υ(C)="0.5" mol ·L-1·s-1
C.υ(B)="0.6" mol ·L-1·s-1 D.υ(A)="0.15" mol ·L-1·s-1
下列有关化学反应速率和限度的说法中,不正确的是( )
| A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快 |
| B.在金属钠与足量水反应中,增加水的量能加快反应速率 |
C.   反应中,SO2不能全部转化为SO3 反应中,SO2不能全部转化为SO3 |
| D.实验室用碳酸钙和盐酸反应制CO2,用碳酸钙粉末比块状反应要快 |
在一定条件的2L密闭容器中,发生A + 3B 2C,在10秒内反应物A物质的量由1 mol降到0.6 mol,则ν(C)为
2C,在10秒内反应物A物质的量由1 mol降到0.6 mol,则ν(C)为
A.0.04mol·(L·s)-1 B.0.08 mol·(L·s)-1
C.0.4 mol·(L·s)-1 D.0.8 mol·(L·s)-1
甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要
| A.快 | B.慢 | C.相等 | D.无法判断 |
实验室测得4molSO2参加下列反应:2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
△H=-196.64kJ/mol,当放出314.3kJ热量时,SO2的转化率最接近于
| A.40% | B.50% | C.80% | D.90% |
纳米是长度单位,1纳米等于1×10-9m,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的
| A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快 |
| B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快 |
| C.常温下“纳米铜”与氧气反应的活化能降低了 |
| D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快。 |
在2A+B  3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=5 mol·L-1·min-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=10 mol·L-1·min-1
下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,其中,你认为不正确的是
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.化学平衡理论可指导怎样使用有限原料多出产品 |
| C.化学反应速率理论可指导怎样提高原料的转化率 |
| D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
右图表示反应N2(g)+3H2(g) 2NH3(g) △H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是
2NH3(g) △H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是
| A.氨气的体积分数最高的一段时间为t5~t6 |
| B.t2~t3和t3~t4时间段氨气的体积分数相等 |
| C.t1时刻改变的条件是降低温度 |
| D.t4~t5时间段平衡向正反应方向移动 |
下列有关化学反应速率的说法正确的是
| A.化学反应速率只能用反应物浓度的减少量来表示 |
| B.反应速率的大小主要取决于反应进行时的外界因素 |
| C.锌与稀硫酸反应制氢气时,加入少量硫酸铜可以加快反应速率 |
| D.催化剂都能加快反应速率,并提高原料的利用率和转化率 |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的是
2AB3(g)反应来说,下列所表示的化学反应速率中最大的是
| A.v(A2)=0.8mol·L-1·s-1 | B.v(A2)=40mol·L-1·min-1 |
| C.v(AB3)=1.0mol·L-1·s-1 | D.v(B2)=1.2mol·L-1·s-1 |
在恒温、恒容的密闭容器中进行反应A(g) B(g)+C(g)。若反应物的浓度由2 mol/L降到0.8 mol/L需20 s,那么反应物浓度由0.8 mol/L降到0.2 mol/L所需反应时间为( )
B(g)+C(g)。若反应物的浓度由2 mol/L降到0.8 mol/L需20 s,那么反应物浓度由0.8 mol/L降到0.2 mol/L所需反应时间为( )
| A.10 s | B.大于10 s | C.小于10 s | D.无法判断 |