已知4NH3+5O2===4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
| A.4v(NH3)=5v(O2) | B.5v(O2)=6v(H2O) |
| C.2v(NH3)=3v(H2O) | D.4v(O2)=5v(NO) |
反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是
2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是
A.  (D)=0.4 mol /(L·s) B.
(D)=0.4 mol /(L·s) B.  (C)=0.5 mol /(L·s)
(C)=0.5 mol /(L·s)
C.  (B)=0.6 mol /(L·s) D.
(B)=0.6 mol /(L·s) D.  (A)=0.15 mol /(L·s)
(A)=0.15 mol /(L·s)
在不同条件下分别测得的反应2SO2+O2 2SO3的化学反应速率,其中表示该反应进行最快的是
2SO3的化学反应速率,其中表示该反应进行最快的是
| A.v(SO2)=0.4mol/(L·min) | B.v(O2)=3mol/(L·min) |
| C.v(SO2)=0.3mol/(L·s) | D.v(O2)=0.2mol/(L·s) |
在一定温度下的容积不变的容器中进行反应2X(g) 2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是( )
2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是( )
2.等于20s B. 等于18s C. 大于20s D. 大于 18s
在2A(g)+B(g)  3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(B)=0.3mol/(L· s) B.v(A)=0.5mol/(L· min)
C.v(C)=0.8mol/(L· s) D.v(D)=1mol/(L· min)
合成氨的反应中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),在四种不同条件下分别测得反应速率如下:
4NO(g)+6H2O(g),在四种不同条件下分别测得反应速率如下:
①V(NH3)=0.8mol·L-1·min-1 ②V(O2)=1.1mol·L-1·min-1
③V(H2O)=1.4mol·L-1·min-1 ④V(NO)=1.2mol·L-1·min-1
则反应速率最快的是
| A.① | B.② | C.③ | D.④ |
在其他条件不变时,增大反应物浓度,反应速率 (填加快、不变或减慢,下同) ,降低温度,反应速率 ;使用正催化剂(简称催化剂)可以 反应速率;有固体参加的反应,增大固体的表面积,反应速率 。
在镁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,则10s内生成氢气的平均反应速率是( )
| A.0.06 mol/(L•s) | B.1.8mol/(L•s) |
| C.1.2 mol/(L•s) | D.0.18 mol/(L•s) |
为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线,在该实验过程中发现锥形瓶温度升高。请分析讨论以下问题。
(1)在O ~ t1、t1 ~ t2、t2 ~ t3各相同的时间段里,反应速率最大的时间段是 ,可能的原因是 ;收集到的气体最多的是 时间段。
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有 ;
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.通入HCl |
(3)在t4后,收集到的气体的体积不再增加,可能的原因是 。
(8分)用纯净的碳酸钙粉末跟稀盐酸反应制取二氧化碳气体,请回答: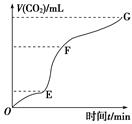
(1)实验过程如图所示,分析判断:________段化学反应速率最快。由该段图像说明:此反应属于________(填“吸热”或“放热”)反应
(2)为了减缓上述反应的化学反应速率欲向溶液中加入下列物质,你认为可行的是________(填字母代号)。
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率________________________________________________________________________
在2A(g)+B(g) 3C(g)+4D(g)中,表示该反应速率最快的是( )
3C(g)+4D(g)中,表示该反应速率最快的是( )
 A.υ(A) = 0.5
A.υ(A) = 0.5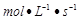 B.υ(B) = 0.3
B.υ(B) = 0.3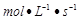
 C.υ(C) = 0.8
C.υ(C) = 0.8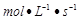 D.υ(D)= 1
D.υ(D)= 1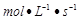
某一化学反应在体积为2L的恒容密闭容器中进行,反应物气体B的物质的量在5 s内从8.0 mol变成2.0 mol,在这5 s内B的化学反应速率为( )
| A.3 mol•L-1•s-1 | B.0.3 mol•L-1•s-1 | C.0.6 mol•L-1•s-1 | D.0.1 mol•L-1•s-1 |
某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
| 实验 编号 |
温度/K |
盐酸浓度 /mol·L-1 |
醋酸浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.20 |
|
a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② |
308 |
0.20 |
|
|
| ③ |
298 |
0.40 |
|
|
| ④ |
|
0.20 |
0.20 |
|
| ⑤ |
|
|
|
(1)请完成上工作表(填写实验④⑤的空格)。
(2)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系如图:
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
(1)2min内,平均反应速率v(O2)= ; v(SO3)= 。
(2)2min时,SO2的浓度为
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) 在密闭容器中进行,3s后,水蒸气的物质的量浓度增加了0.045 mol/L,则用水蒸气表示的平均反应速率为( )
4NO(g)+6H2O(g) 在密闭容器中进行,3s后,水蒸气的物质的量浓度增加了0.045 mol/L,则用水蒸气表示的平均反应速率为( )
| A.0.045 mol/(L·s) | B.0.015mol/(L·s) |
| C.0.010 mol/(L·s) | D.0.0075 mol/(L·s) |