氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4  2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。
(1)回答下列问题:(1)该实验中A部分的装置是 (填标号) 。
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): 。
(3)写出D装置中发生反应的离子方程式 (4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L−1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 === Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为 。
(1)已知20oC时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________。
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;通过必要的计算和推理判定:
甲溶液为 溶液,乙溶液为 溶液。
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量(mol)的关系如图
计算
(1)a处沉淀的总物质的量 mol
(2)c(FeCl3)= mol/L
(3)c(AlCl3)= mol/L
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是 。
(2)在由水电离产生的c(H+)=1×10-14 mol·L-1的溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Mg2+、Cl-、NO3-③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定可以大量共存的是 (填序号,下同),可能大量共存的是 。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
| A.Cl2+H2O=HCl+HClO |
| B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ |
D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
(5)右图是某品牌饮用矿泉水标签的部分内容。请认真阅读标签内容后计算。
①该矿泉水中镁离子的物质的量浓度的最大值是 ;
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过 mol。
(10 分)已知:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空:
(1)amol NO完全转化为HNO3需要空气______mol;
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为_______(保留2位小数)。
(3)20.0moL的NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
Ⅰ、质量相等的O3和O2中,分子个数之比为___________,原子个数之比为____________;
如果是在相同温度和相同压强条件下(O3为气体)O3与O2的体积比为___ ________。
Ⅱ、某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.2mol/L。现将一定量的铁粉投入到该溶液中(不考虑溶液的体积变化),回答下列问题:
(1)原溶液中Cu2+的物质的量浓度为 ;
(2)反应后测得Cl-的物质的量浓度为 ;
(3)若反应后测得Fe2+的溶液为0.05mol/L,则反应生成铜单质的质量为 ;
(4)剩余的Cu2+的物质的量浓度为 。
向NaOH溶液中通入CO2气体,充分反应后,在所得溶液中逐滴加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示。
试填写下列空白: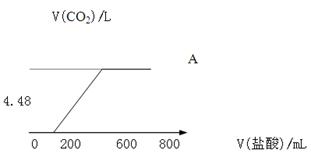
V(CO2)/L
(1)与盐酸反应前,A溶液中的溶质是 。
(2)其物质的量之比是 。
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol—1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
(10分)已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓) CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中__________(填写化学式,下同) 失去电子,氧化剂
是____________。
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为_________L (假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:______________________________________________________
计算反应后所得沉淀的质量为__________________g(保留到0.1g)。
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
⑴根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加___________g。
⑵配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O g。
⑶现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g。
①吸收液中NaNO2和NaNO3的物质的量之比
② 1000g 质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2 克(0℃时,NaNO2的溶解度为71.2g/100g水)
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3 g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g.
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________,阴离子是________.
(2)该结晶水合物的化__________________________________________________.
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5 mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl—、ClO—、ClO3—三种含氯元素的离子,其中ClO—、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
(1)t1前,氧化产物是________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为: 。
(3)该石灰乳中含有Ca(OH)2的物质的量是 mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是 。
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
硫磺在科学技术和生产中有重要的应用。石硫合剂是一种很好的植物杀虫剂,它是硫磺与石灰、水等反应所得――由多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物。不同比例的石灰和硫磺在水溶液中反应,可生成不同的多硫化钙和硫代硫酸钙。如:
3Ca(OH)2+8S 2CaS3+CaS2O3+3H2O;
2CaS3+CaS2O3+3H2O;
3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O等。
2CaS2+CaS2O3+3H2O等。
根据题意完成下列计算:
(1)、硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,通过计算确定Na2Sx中x= 。
(2)、取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/mL)通入足量CO2使其快速分解。原理如下:
Sx2-+2H2O+2CO2→(x-1)S↓+H2S↑+ 2HCO3-,S2O32- + H2O+CO2→HSO3-+HCO3-+S↓ 。
完全反应后共收集到气体1.12升(S·P·T)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 。(答案用小数表示,保留2位有效数字)
(3)、如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 。
(4)、现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推算过程)。
照相底片的感光材料上含有一层AgBr胶体粒子的明胶,照相感光过程中,在光的作用下,AgBr分解成“银核” AgBr→Ag+Br 显影时,感光材料经过显影液作用,含有银核的AgBr粒子被还原为金属银,成为黑色成像,而大量未感光的AgBr粒子在定影时,与定影液中的硫代硫酸钠(Na2S2O3)反应形成 [Ag(S2O3)2]3-络离子而溶解于定影液中:
Ag+ + 2S2O32-= [Ag(S2O3)2]3-
本实验采用简单的化学沉淀方法从废定影液中回收银的方法。其原理是在废定影液中加入硫化钠与定影液中的络离子中的银转化为Ag2S沉淀,并使定影液再生,;再将硫化银送至高温炉灼烧,硫化银就分解为单质银和二氧化硫气体,就达到回收银的目的。
(1)写出Na2S与Na3[Ag(S2O3)2]反应的化学方程式
(2)如果废定影液中含银量为5.68g.L-1 试计算2升废定影液中至少加入Na2S的物质的量是 。(保留小数点后四位数)
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
(1)写出反应过程中的离子反应方程式:
OC段 ,
DE段 ,
EF段___________________________________ __________。
(2)硝酸溶液的物质的量浓度为 mol·L-1
(3)B的值为_________mol,C的值为 mL。