设NA代表阿佛加德罗常数的值,下列说法正确的是
①1 L pH=1的硫酸溶液中含有的H+数为0.2NA
②标准状况下,2.24 L乙烯和丙烯的混合气体中含有的碳原子总数0.2 NA
③7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
④反应3H2(g)+N2(g)  2NH3(g)ΔH="-92" kJ/mol放出热量9.2 kJ时,转移电子数0.6 NA
2NH3(g)ΔH="-92" kJ/mol放出热量9.2 kJ时,转移电子数0.6 NA
⑤常温常压下,1mol氦气含有的核外电子数为4NA
⑥常温常压下,1mol甲基(—14CH3)中所含的中子数为8NA
| A.① ② | B.④ ⑤ | C.④ ⑥ | D.③ ⑤ |
设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.在反应中消耗0.1molCl2,转移的电子数一定为0.2NA |
B.15gCH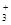 (碳正离子)中含有的电子数为10NA (碳正离子)中含有的电子数为10NA |
| C.标准状况下,0.5mol氦气含有的电子数为NA |
D.0.1L 2mol·L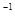 的(NH4)2S溶液中含有的S 的(NH4)2S溶液中含有的S 数目为0.2 NA 数目为0.2 NA |
设nA表示阿伏加德罗常数的数值,下列有关说法正确的是
| A.1 mol Cu和足量的硫反应,转移的电子数为nA |
| B.标准状况下,22.4 L氯仿中含有的分子数为nA |
| C.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1nA |
| D.53.5g NH4Cl中含有的分子数为NA |
设NA表示阿伏加德罗常数的数值,下列叙述正确的是
| A.常温常压下,2.8 g N2与C2H4的混合气体中含有的电子数为1.4NA |
| B.标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA |
| C.25 ℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| D.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氧原子数为0.3NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4 L气体 |
| B.2 L 0.05 mol/L乙酸溶液中H+数为0.1NA |
| C.等物质的量的Na2O和Na2O2中含有的阴离子总数不同 |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
用NA表示阿伏加徳罗常数的值,下列说法正确的是
| A.常温常压下,2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
| B.25℃时,2L0.1mol/L的Na2CO3溶液中含有的CO32-总数为0.2NA |
| C.某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO3分子数为0.2NA |
| D.30g乙酸和甲醛的混合物中氧原子数为NA |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.58g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| B.用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA |
| C.142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
| D.已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
【改编】用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.室温下,48.0 gO2和O3的混合气体中含有的氧原子数目为1.5NA |
| B.取2.5L 3.2 mol·L-1NaHCO3溶液 ,所得溶液含有8 NA个HCO3- |
| C.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的Ba2+的数目为0.1NA |
| D.标准状况下,2.24 L Cl2通入足量FeCl2溶液反应,溶液颜色变黄,转移的电子总数为0.2NA |
(6分)现有0.1 mol·L-1的Na2SO4和0.1 mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
(1)当加入50 mLBa(OH)2溶液时,所得溶液中的溶质是 ,其物质的量浓度为 mol·L-1。
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液中溶质为 ,则该溶质物质的量浓度为 mol·L-1
VL Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A. mol/L mol/L |
B. mol/L mol/L |
C. mol/L mol/L |
D. mol/L mol/L |
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
| A.所含共用电子对数目为(a/7+1)NA | B.所含碳氢键数目为aNA/7 |
| C.燃烧时消耗的O2一定是33.6a/14 L | D.所含原子总数为aNA/14 |
两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为 
| A.①>② | B.①<② | C.①=② | D.不能确定 |
设NA为阿伏加德罗常数的数值,则下列说法中正确的是
| A.2.4 g金属镁所含电子数目为0.2NA |
| B.1 mol CH4所含质子数目为10NA |
| C.标准状况下22.4 L H2O所含分子数目为NA |
| D.18 g NH4+所含电子数目为10NA |
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
| A.V1>V2>V3 | B.V1>V3>V2 | C.V2>V3>V1 | D.V3>V1>V2 |
设NA表示阿伏加德罗常数的值,下列说法中正确的
①一定条件下定容容器中充入3molH2(g)和1molN2(g)发生反应:3H2(g)+N2(g)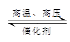 2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
②常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA
③14.2g硫酸钠固体中含有0.1NA个硫酸钠分子;
④2gD216O中含有的质子数、中子数、电子数均为NA
⑤标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
⑥将100mL0.1mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
| A.①③⑥ | B.④⑤⑥ | C.①②④ | D.①⑥ |