阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A.1.0 L 1 mol·L-1氨水中,NH3·H2O的分子数为6.02×1023 |
| B.当有7.1 g Cl2和水完全反应时转移的电子数为0.1×6.02×1023 |
| C.白磷分子(P4)呈正四面体结构,31 g白磷中含有P—P键个数为6×6.02×1023 |
| D.20 g重水(2H216O)中含有的中子数为8×6.02×1023 |
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合价越低。若硝酸现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。求:
(1)B与A的差值: mol;
(2)B的数值: mol;
(3)C的数值: mL。(要求有计算过程)
设NA为阿伏加德罗常数,下列说法正确的是( )
| A.常温常压下,0.2NA个NH3分子的质子数NA |
| B.1 mol NaCl中,所有Na+的最外层电子总数为8NA |
| C.7.1g Cl2变为氯离子时,得到的电子数一定为0.1NA |
D.1L 0.2 mol/L硫酸铁溶液中含有的SO 离子数目为0.2NA 离子数目为0.2NA |
设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A.标准状况下,4.48L氦气和重氢气(D2)的混合物中所含中子数为0.4NA |
| B.常温下,0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
C.10.6gNa2CO3固体中,所含CO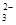 的数目为0.1NA 的数目为0.1NA |
| D.足量铜与0.1L18.4mol·L-1”浓硫酸反应,生成SO2的分子数一定小于0.92NA |
NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.0.5molO3与11.2LO2所含的分子数一定相等 |
| B.在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA |
| C.常温常压下,7.0g乙烯与丁烯的混合物中含有氢原子的数目为NA |
| D.标准状况下,22.4 L氯气与足量铁粉充分反应,转移的电子数为3 NA |
现有等物质的量的NaHCO3、KHCO3的混合物a g与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3与KHCO3的质量比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸物质的量浓度为 mol·L-1。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积范围是 。
设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A.常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA |
| B.常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子 |
| C.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA |
| D.1mol甲醇中含有C—H键的数目为4NA |
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如下图所示。则:
(1)写出代表各线段发生反应的离子方程式:
OD段 _________________________________,
DC段 _________________________________ 。
(2)原溶液中Mg2+、Al3+物质的量浓度之比为 。
(3)图中C点表示当加入 mol NaOH时,Al3+已经转化为 Mg2+已经转化为 。
(4)图中线段OA∶AB= 。
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.16 g CH4中含有4 nA个C—H键 |
| B.1 mol/L NaCl溶液含有nA个Na+ |
| C.1 mol Cu和足量稀硝酸反应产生nA个NO分子 |
| D.标准状况下,22.4 L己烯中含有nA个CO2分子 |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17 g甲基(-14CH3)所含的中子数为9NA
②常温常压下,22.4 L NO气体的分子数小于NA ③64 g铜发生氧化还原反应,一定失去2NA个电子 ④常温常压下,100 mL 0.5 mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA ⑤标准状况下,22.4 L二氯甲烷所含有的分子数为NA ⑥常温常压下,1 mol氦气含有的核外电子数为4NA
| A.①② | B.③④ | C.②④ | D.⑤⑥ |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A. |
B. |
C.n=m+17Vc | D. m<p< m<p< |
用NA表示阿伏加德罗常数的值,则下列叙述正确的是
| A.标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B.常温下,1.0L 1.0 mol·L-1NaAlO2溶液中含有的氧原子数为2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D.0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2 NA |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标况下,11.2L的戊烷含有分子数为0.5NA个 |
| B.常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
| C.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
| D. 1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.1.7g H2O2中含有的电子数为0.9 NA |
| C.1mol Na2O2固体中含离子总数为4 NA |
| D.标准状况下,2.24L戊烷所含分子数为0.1 NA |