关于氢键,下列说法正确的是
| A.每一个水分子内含有两个氢键 |
| B.冰、水中都存在氢键 |
| C.分子间形成的氢键使物质的熔点和沸点降低 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
某物质结构如图。下列有关该物质的说法正确的是
| A.分子式为C3H4O3 | B.分子中含8个σ键 |
| C.分子中只有极性键 | D.8.6g该物质完全燃烧得到6.72LCO2 |
物质的变化千奇百怪,但概括起来就两大类,即物理变化和化学变化,下列说法正确的是
| A.有化学键破坏的变化不一定属于化学变化 |
| B.发生了颜色变化的一定是化学变化 |
| C.有单质参加和生成的变化一定是氧化还原反应 |
| D.爆炸一定是化学变化 |
(1)某烃A燃烧的化学方程式为:CxHy+(x+ )O2 → xCO2+
)O2 → xCO2+ H2O,该反应为 反应(填“吸热”或“放热”);将0.2 mol A完全燃烧生成4.48 L(标准状况下)CO2和7.2 g H2O,则烃A的结构式 。
H2O,该反应为 反应(填“吸热”或“放热”);将0.2 mol A完全燃烧生成4.48 L(标准状况下)CO2和7.2 g H2O,则烃A的结构式 。
(2)试分析下列情况下微粒间作用力的变化情况(填“离子键”、“极性键”、“非极性键”或“分子间作用力”)
①MgCl2溶于水时破环 ;
②碘升华破坏 。
根据下列短周期元素性质的数据判断,下列说法正确的是
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径/10-10 m |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
| 最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
| -2 |
|
|
-3 |
-1 |
|
-3 |
|
A.元素⑦位于第3周期ⅤA族
B.元素⑤⑥形成的化合物是共价化合物
C.元素①⑧形成的化合物具有两性
D.元素③的最高价氧化物对应水化物碱性最强
关于化学键的下列叙述中,正确的是
| A.凡金属元素与非金属元素化合时都能形成离子键 |
| B.非金属原子间不可能形成离子键 |
| C.钠原子与氯原子通过得失电子,以离子键结合成氯化钠后体系能量降低 |
| D.含有共价键的化合物一定是共价化合物 |
下列说法正确的是
A.用电子式表示氯化氢分子的形成过程: |
| B.一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小 |
| C.酸与碱发生中和反应时放出的热量叫中和热 |
| D.催化剂不但能改变反应速率,也能改变反应进行的限度 |
下列变化过程中,化学键没有被破坏的是
| A.HCl溶于水 | B.干冰升华 |
| C.固体NaCl熔融 | D.煤矿中瓦斯(主要成分CH4)遇火爆炸 |
下列说法正确的是
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
| A.①③⑥ | B.②④⑥ | C.②③④ | D.①③⑤ |
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化物是两性氧化物的元素是___________;写出它的氧化物与氢氧化钠反应的离子方程式________________________。
(4) 用电子式表示元素④与⑥形成的的化合物的形成过程______________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为__________________,该化合物是由___________ (填“极性”“非极性”)键形成的。
(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_________填序号),写出反应⑥的化学方程式__ ____。
(3)在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是 ,
②只有极性共价键的共价化合物是 ,
③只含有非极性共价键的是 ,
④既有离子键又有非极性键的化合物是 。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_________,B为________,C为__________。
(2)E的电子式为_____________。
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:_______________。
下列物质中既有离子键又有共价键的是
| A.CaCl2 | B.H2O | C.K2O | D.NaOH |
现有A、B、C、D四种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)B在周期表中的位置 。
(2)写出A的氢化物中原子个数为1:1的物质的电子式: 。
(3)写出CD的溶液与氯气反应的离子方程式 。
(4)比较A、B两种元素形成的简单离子半径的大小(用离子符号表示): 。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答: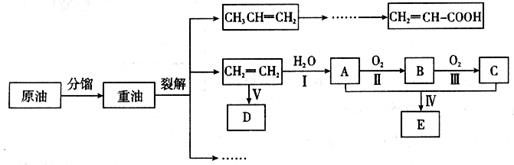
已知:
(1)写出A的电子式 。
(2)反应II的化学方程式是__________。
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(4)E是有香味的物质,在实验室用下图装置制取。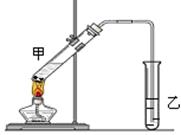
①反应IV的化学方程式是__________,该反应类型为______。
②该装置图中有一个明显的错误是 。
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 |
试管甲中试剂 |
试管乙中试剂 |
有机层的厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和_____mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。