在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A.将SO2通入水中 | B.烧碱溶于水 | C.将HCl通入水中 | D.硫酸氢钠溶于水 |
下列说法正确的是
A.分子内共价键越强,分子越稳定,其熔沸点也越高
B.C、H、O、N四种元素组成的化合物一定是离子化合物
C.HF分子间存在着氢键,所以HF比HCl稳定
D.由原子构成的晶体可能是原子晶体,也可能是分子晶体
下列说法正确的是
A.质子数为6,中子数为7的原子的元素符号可表示为 |
| B.H2、SO2、CO三种气体都可用浓硫酸干燥 |
| C.共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏 |
| D.陶瓷、玻璃、水泥、大理石的主要成分都是硅酸盐 |
X、Y二元素的原子,当它们分别获得两个电子形成稀有气体元素原子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是
| A.Z2X | B.Z2Y | C.W2X | D.W2Y |
下列有关作用力的说法正确的是( )
| A.金属键、离子键、分子间作用力、氢键都没有方向性和饱和性 |
| B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱 |
| C.离子键、金属键、氢键、范德华力本质上都是静电作用 |
| D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键 |
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
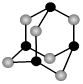
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如右图所示的实验,发现烧杯中溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是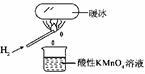
A水凝固形成20~C时的“暖冰”所发生的变化是化学变化
B.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
下列叙述正确的是
①任何化学反应都有反应热 ②化合物MgO、SiO2、Al2O3中化学键的类型相同 ③有些化学键断裂时吸收能量,有些化学键断裂时放出能量 ④PH3分子稳定性和沸点均低于NH3分子 ⑤O3和NO2都是共价化合物 ⑥有热量变化的过程一定有化学键的断裂与形成 ⑦单质中不可能有离子键 ⑧有化学键断裂的变化属于化学变化
| A.①④⑦ | B.②③ | C.③⑤ | D.②⑤⑥ |
下列关于化学键的说法正确的是
A.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键
B.不同元素的原子构成的分子不一定只含极性共价键
C.含极性键的共价化合物一定是电解质
D.HF的分子间作用力大于HCl,故HF比HCl更稳定
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )

| A.S2Cl2的结构式为Cl-S-S-Cl |
| B.若S2Br2与S2Cl2结构相似,则熔沸点:S2Br2>S2Cl2 |
| C.S2Cl2为含有极性键和非极性键的非极性分子 |
| D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
下列观点正确的是 ( )
| A.化合物电离时,生成的阴离子是氢氧根离子的是碱 |
| B.某化合物的熔融状态能导电,该化合物中一定有离子键 |
| C.某化合物的水溶液能导电,该化合物一定是电解质 |
| D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 |
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
| A.K3C60中只有离子键 | B.K3C60中不含共价键 |
| C.该晶体在熔融状态下能导电 | D.C60与12C互为同素异形体 |