(1)在1—18号元素中,能形成最稳定气态氢化物的元素是 ;与水或酸反应最剧烈的金属单质是 ;最高价氧化物的水化物中碱性最强的元素是 ;最高价氧化物的水化物中酸性最强的元素是 。(填写元素符号)
(2)物质在下列变化过程中克服的是:a分子间作用力 b共价键 c离子键(填序号)
①冰融化 ;
②食盐熔化 ;
③H2S受热分解成S和H2 ;
④NaHSO4溶解于水 ;
(3)共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是_________
| A.干冰 | B.氯化钠 | C.氢氧化钠 | D.碘 |
(4)氮化钠是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答,Na3N的电子式是________, Na3N与盐酸反应方程式_____________________________________;
现有A、B、C、D、E、F、G七种元素,期中 A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;D的次外层电子数为最外层的三分之一;E原子半径在同周期中除稀有气体外最大,E与F可形成离子化合物EF,G的合金在生活中用量最大,用途最广。
(1)G在元素周期表中的位置是______________
(2)D、E、F离子半径由大到小顺序为:___________________(用离子符号表示)
(3)A与D形成原子个数比为1:1化合物的电子式为:_________________________
(4)D与E形成某离子化合物具有漂白性,该化合物和B与D形成的某化合物反应的化学方程式为:_______________________,试写出利用该反应原理在生活中的一个用途:_____________
(5)若X为正盐,加热该盐的化学方程式为:____________________________________
(6)用电子式表示EF的形成过程:______________________________________________
(7)B、C、F三种元素最高价氧化物的水化物的酸性由强到弱的顺序为:___________________
(1)下列7种固态物质:
| A.P4 |
| B.SiO2 |
| C.NH4Cl |
| D.Ca(OH)2 |
E.NaF
F.CO2(干冰)
G.金刚石
回答下列问题(填字母代号):
①既有离子键又有共价键的是 。
②熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 。
(2)某元素最高正化合价为+6,其最低负价为 。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为 。
根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧Al
(1)只含有离子键的是 (用序号回答,下同)
(2)含有共价键的离子化合物是
(3)属于共价化合物的是
(4)熔融状态能导电的化合物是
(5)熔融状态时和固态时,都能导电的是
根据下面的描述,按照要求回答下列问题
(1)画出H2O2的电子式:__________
(2)请画出HClO的电子式:__________
(3)用电子式表示出离子化合物MgCl2的形成过程__________
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是__________,画出电子式_________
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸镁的平均反应速率是__________mol·L-1s-1 。
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|
|
|||||
| |
|
|
d |
e |
|
|
|
| b |
c |
|
|
f |
|
g |
|
(1)元素的原子间最容易形成离子键的是下列中的 (填选项),元素的原子间最容易形成共价键的是下列中的 (填选项)。
A、c和f B、b和g C、d和g D、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是 (填选项)
A、ea3 B、ag C、fg3 D、dg4
按要求填空:
(1)羟基的电子式是 ;
(2)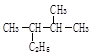 用系统命名法命名为 ;
用系统命名法命名为 ;
(3)2-甲基-1,3-丁二烯的键线式为 ;
(4)乙醛与银氨溶液反应的化学方程式: ____________________。
(1)完成下列物质的电子式
| A.Na+, | B.Cl-, | C.H2O, | D.Na2O2 , |
(2)用电子式表示下列化合物的形成过程
H2O ; MgCl2 。
有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、 Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称 ,N在元素周期表中的位置 。
(2)离子半径比较:r(Z+) r(Y2—)。(填“>”、“=”或“<”)
(3)X与Z形成的化合物A是 (填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是 。
下表列出了①~⑨九种元素在周期表中的位置。请回答(用化学用语):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑤ |
|
⑥ |
|
|
| 3 |
① |
③ |
④ |
|
|
|
⑦ |
⑨ |
| 4 |
② |
|
|
|
|
|
⑧ |
|
(1)在这些元素中,最活泼的金属元素是 ;最活泼非金属元素是 ;最不活泼的元素是 。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式 ;能形成两性氢氧化物的元素是 。
(3)①、②、③三种元素的原子半径由大到小的顺序依次为 。
(4)⑥元素的氢化物是 ,该氢化物在常温下与②发生反应的化学方程式为 ,所得溶液的PH 7.
(5)用电子式表示 ①和⑧元素形成化合物的过程 。
(1)指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数:______________________。
(2)在[Fe(CN)6]3-中,中心原子的配位数为__________,配体的立体构型是__________。
(3)配合物[Cr(H2O)4Br2]Br·2H2O中,中心原子的化合价为__________,内界的电荷数为__________。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
①D在周期表中的位置是____ ;
②用电子式表示A、B形成化合物的过程:____ ;
③D2C的电子式为 ;
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为 。D在周期表中位置 。
(2)写出E的电子式: 。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。