三种常见元素结构信息如下表,试根据信息回答有关问题:
| 元素 |
A |
B |
C |
| 结构信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3s104sx,有+1、+ 2两种常见化合价 2两种常见化合价 |
(1)写出B原子的基态电子排布式 ;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键 (任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 ;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。
在以上分子中,中心原子采用 杂化形成化学键是 (填写序号);在②的分子中有 个
杂化形成化学键是 (填写序号);在②的分子中有 个 键和 个
键和 个 键。
键。
水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
( 2)已知2H2O
2)已知2H2O 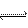 H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以 作还原剂;
作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH 均为7;
均为7;
⑥水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定 性: 沸点:
性: 沸点:
(4分)在下列化合物中:H2O、Na2O、I2、、N aCl、、KOH、CO2、NH4Cl、Na2O2,请填空:
aCl、、KOH、CO2、NH4Cl、Na2O2,请填空:
(1)只由非金属组成的离子化合物是 ,
(2)含有极性共价键的离子化合物是 ,
(3)只含有非极性共价键的是 ,
(4)既有离子键又有非极性键的化合物是 。
下列是中学化学常见的物质
A.金刚石 B.HCl C.NaCl D.Na2 SO4 E.Na2S F .He G.N2
请用序号回答(1)-(4)题:
(1)这些物质中只含共价键的是
(2)既含离子键又含共价键的是
(3)固态时属于离子晶体的是
(4)熔化时需克服共价键的是
(5)试写出E. G的电子式:
在1×105Pa和298K时,将拆开1mol共价键 所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
| 共价键 |
H-H |
N≡N |
N-H |
| 键能(kJ·mol-1) |
436 |
945 |
391 |
(1)根据上表中的数据判断工业合成氨的反应:N2+3H2 2NH3是___________(填“吸热”或“放热”)反应;
2NH3是___________(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反 应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是 ( )
A. Q1>Q2 B. Q1<Q 2 C. Q1=Q2
2 C. Q1=Q2
如此选择的理由_________________________________________________;
⑷.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是_______________________.
2NH3。下列有关说法正确的是_______________________.
A.达 到化学平衡时,正反应和逆反应的速率都为零。
到化学平衡时,正反应和逆反应的速率都为零。
B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态。
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D. k反应达到平衡状态,最多可生成氨2 mol。
E. 工业 合成氨,我们希望提高反应物的转化率并加快反应速率。
合成氨,我们希望提高反应物的转化率并加快反应速率。
F.氨分子内形成氢键,使氨的沸点升高.
G.氮分子的分子间作用力大,使氮分子化学性质很稳定.
H.氢能源属于化石能源.
在下列物质中:① CO2 ② KCl ③ CaBr2 ④ O2 ⑤ NH4Cl ⑥ Ca(OH)2 ⑦ N2 ⑧ HBr ⑨ NH3 ⑩ Na2O2
(1)有离子键也有非极性键的是 (2)属于离子化合物的是
(3)只有非极性键的是 (4)只有离子键的是
(6分)⑴在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是 ,只含有极性键的是 ,既含离子键又含非极性共价键的是 。
(2)写出下列物质的电子式:
CO2 NaCl HClO
研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 , 的未成对电子数是 。
的未成对电子数是 。
(3) 中的
中的 与
与 互为等电子体。已知
互为等电子体。已知 、
、 两种粒子中各原子最外层均为8电子稳定结构。
两种粒子中各原子最外层均为8电子稳定结构。 的电子式可表示为 ;
的电子式可表示为 ; 中含有的
中含有的 键数目为 。
键数目为 。
下列五种物质中① Ar ② H2O2 ③ NH4 NO3 ④ KOH ⑤ Na2O2 ⑥ CaCl2只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。(填写序号)
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系: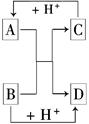
①A的电子式是
②加热条件下A与B在溶液中反应的离子方程式
③C中含有的化学键类型为:
④铝可以与B的某溶液反应,写出此反应的离子方程式
(12分)(1)用电子式表示H2O和MgBr2的形成过程
H2O MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:
CO2 Na2O2 H2O2
(3) H2O以 键结合,MgBr2以 键结合。NaOH以 键结合,Na2O2以 键结合(填极性键、非极性键、离子键)
(4) 、
、 、
、 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:① ;②
;② 。
。 据此,回答下列问题:
据此,回答下列问题:
①写出①反应的离子方程式 。
② 和C-的电子式
和C-的电子式 ____________、C-____________。
____________、C-____________。
PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体: ,黄绿色固体:
⑶淡黄色固体物质是由 分子组成,黄绿色固体物质是由 分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是 。
(6分) 在H2、NH4Cl、SiC、CO2、HF中,由极性键形成的非极性分子有(1)________,由非极性键形成的非极性分子有(2)________,能形成分子晶体的物质是(3)________,含有氢键的晶体的化学式是(4)________,属于离子晶体的是(5)________,属于原子晶体的是(6)________。
(8分)
⑴在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又有极性键的是 。
⑵写出短周期元素中有关的元素符号或名称。
①某元素最外层电子数是次外层电子数的2倍,该元素符号是 ;
②某元素次外层电子数是最外层电子数的2倍,该元素符号是 ;
③某元素K层与M层电子数相同,该元素名称是 ;