H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第________周期第________族;C的基态原子核外有_________对成对电子;Cl原子的价电子表示式________.
(2)用“>”、“=”、“<”填空
| 稳定性 |
得电子能力 |
离子半径 |
电负性 |
| CH4____NH3 |
1H_____2H |
Na+_____Al3+ |
C____Al |
(3)用电子式表示NaCl的形成过程:__________________________________________.
(4)已知在常温常压下:
| 化学键 |
H—H |
H—Cl |
Cl—Cl |
| 键能kJ/mol |
a |
b |
c |
写出H2与Cl2反应的热化学方程式:_________________________________________.
(共10分)用下列:①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤Cl2 ⑥Ar ⑦CO2 等物质填空。 (1—4小题填序号)
(1)由离子键和非极性键构成的是
(2)由极性键和非极性键构成的是
(3)不存在化学键的是
(4)共价化合物有
(5)写出下列物质的电子式:Na2O2
(12分)下列物质:①H2②HF ③H2O2 ④KF ⑤NH4Cl ⑥C2H2⑦N2H4+⑧BF3⑨H2O ⑩N2(填序号)
(1)只含非极性键的是___________________
(2)只含极性键的极性分子是_____________
(3)既有极性键又有非极性键的是_________
(4)只有σ键的是_______________________
(5)既有σ键又有π键的是_______________
(6)含有配位键的是_____________________
(14分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________________________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是
________________________________,________________________________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。
(10分)X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2X属于________(共价或离子)化合物。
(3)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是_______________。
有以下物质:①Ne;②NH4Cl;③KNO3;④NaOH;⑤Cl2;⑥SO2;⑦H2S;⑧Na2O2;⑨MgCl2。请用上述物质的数字序号填空:
(1)只存在离子键的是
(2)既存在离子键又存在极性键的是
(3)不存在化学键的是
(4)属于共价化合物的是
(共4分)(1)写出下列物质的电子式: HClO 。
(2)用电子式表示下列物质的形成过程:CaCl2 。
现有①NaCl ②金刚石 ③Na ④NaHSO4 ⑤干冰 ⑥碘片六种物质,按要求回答下列问题(填序号):
(1)属于离子化合物的是 ,只有离子键的物质是 ,晶体以分子间作用力结合的是 。
(2)NaHSO4熔融状态下电离,破坏了 键,写出电离方程式
(3)判断①、②、③、⑤熔沸点高低顺序
现有下列几种物质:
①CaS ②Ar ③CaO2 ④金刚石 ⑤SiC ⑥H2O2 ⑦(NH4)2SO4 ⑧MgCl2 ⑨CH3COONa ⑩[Cu(NH3)4]SO4 (以下空格均填写序号)
(1)不含极性键的分子晶体是 ;(2)含有极性键的分子晶体是 ;
(3)只含离子键的离子晶体是 ;(4)含有极性键的原子晶体是 ;
(5)含有非极性键的离子晶体是 ;(6)含有配位键的离子晶体是 。
(12分)(1)下列变化(填序号)①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。
未发生化学键破坏的是 ;仅发生离子键破坏的是 ;
仅发生共价键破坏的是 ;既发生离子键又发生共价键破坏的是 ;
(2)用电子式写出MgCl2、HCl的形成过程
①MgCl2的形成过程: ;
②HCl的形成过程: ;
(15分,除标明外,其余每空2分)铜锰氧化物(CuMnO4)可以在常温下催化氧化空气中的一氧化碳和甲醛,因而对新装修的住房有益。
(1)基态Cu2+的电子排布式为 。
(2)甲醛(HCHO)中C原子的杂化方式为 ,它的空间构型为 ,1mol甲醛分子中含 molσ键。
(3)CO常与金属形成羰基化合物,Fe(CO)5的结构示意图是 ;与CO互为等电子体的分子、离子分别是 、 。
按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:
(1)平面三角形分子:分子式 ,中心原子杂化方式是 .
(2)三角锥形分子:分子式 ,VSEPR模型的名称为 .
(3)正四面体形分子:结构式
(4)与O22+互为等电子体的一种化合物的分子式为 ,O22+的电子式可表示为_____,1mol O22+ 中含有的 键数目为_____。
键数目为_____。
氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
a.电子层 b.电子亚层
c.电子云的伸展方向 d.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 。
核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。
在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
| 共价键 |
键能(KJ/ mol) |
| N≡N |
946 |
| H-H |
436 |
| H-N |
391 |
27.钯(Pd)是优良的储氢金属:2Pd(s)+xH2(g)
 2PdHx (s) +Q(Q>0)
2PdHx (s) +Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
a.升温 b.减压 c.及时移走金属钯
(1)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为 ,其沸点比氨气 (填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为 。
(2)类似于碳原子,氮原子间也可形成链状结构。某链状结构氮氢化合物中,氮原子间只以N-N单键形式连接形成氢化物。该系列氮氢化合物化学通式为 (n表示氮原子个数)。
(3)生活中广泛使用烃类物质(CmHn)燃料,火箭发射时的高能燃料常用氮氢化合物,比如肼N2H4。2014年10月31日在测试飞行时坠毁的维珍银河公司“太空船2号”商业载人飞船用N2H4燃料,但助燃剂选择不当据说是事故原因之一。经分析该助燃剂分子由氮、氧原子组成,分子中原子最外层电子总数和CO2分子中原子最外层电子总数相同。该助燃剂的化学式为 。上述燃烧反应产物绿色、环保,书写该燃烧反应的化学方程式为 。
(4)分子式为N4的氮元素同素异形体,结构等同于白磷,N4中每个原子满足最外层8e-结构。则1molN4中含有 对共用电子对。已知NH3、-NH2、 、
、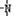 一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是 。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是 ,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为 ,它比同主族其他元素的氢化物沸点高的原因是 。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象: 。