下列五种物质中,①H2O ②CO2③Na2O2 ④NaOH ⑤NaBr,只存在共价键的是__________,只存在离子键的是__________,既存在离子键又存在共价键的是_________,含有极性键的是__________,是非极性分子的是________。(填编号)下
(2分)已知元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键。
Be(1.5)和F(4.0):____________,Si(1.8)和Cl(3.0):____________。
I.现有下列物质:
1、CI2 2、Na2O2 3、NaOH 4、HCl 5、H2O2 6、MgF2 7、Mg3N2
(1)只有离子键构成的物质是 (2)只有极性键构成的物质是
(3)只有非极性键构成的物质 (4)有极性键和非极性键构成的物质是
(5)有离子键和极性键构成的物质是(6)有离子键和非极性键构成的物质是
(7)属于离子化合物的是 (8)属于共价化合物的是
II.能够说明可逆反应2NO2 N2O4达到平衡状态的标志是_____________
N2O4达到平衡状态的标志是_____________
①单位时间消耗2mol NO2的同时,生成1 mol N2O4 ②恒温恒压下,混合气体的密度不变 ③NO2和N2O4的浓度之比为2∶1 ④混合气体的颜色不变 ⑤单位时间消耗4mol NO2的同时,消耗2mol N2O4
下图是元素周期表的前四周期的结构,请回答
| A |
|
|
|||||||||||||||
| |
|
|
|
B |
C |
D |
|
|
|||||||||
| E |
|
F |
|
|
|
G |
|
||||||||||
| |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
⑴请写出各元素的元素符号:A 、B 、C 、D 、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式 ,指出化合物M中的化学键类型 。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:
(6分)现有①H2O2 ②HClO ③NH4Cl ④Na2O2 ⑤干冰 五种物质,按下列要求回答:(填序号)
(1)既存在离子键又存在共价键的是 。
(2)写出①的电子式是_____ ___,②的电子式是_____ ___,
③的电子式是_____ ___,④的电子式是_____ ___,
⑤的电子式是___ _ ____,
(1)在下列物质中:
| A.氩 | B.NaOH | C.甲烷 | D.氯化钡(E)乙烯(F)NH3(G)CCl4(H)H2O2 ①只含离子键的物质是_____________;②既有离子键又有共价键的化合物是__________;③只含极性键的物质是__________ ;④含非极性键的物质是____________;(选填序号) |
(2)下列变化①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。未发生化学键破坏的是 ;仅发生离子键破坏的是_____;仅发生共价键破坏的是 ;
在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥结构的极性分子是 。
(4)以极性键相结合,具有V结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
在NaF、NaOH、CaO、Cl2、NH4Cl、H2O2等物质中只含有离子键的物质有: ;只含有共价键的物质有: ;既含有离子键又含有共价键的物质有: ;属于离子化合物的有: ;属于共价化合物的有: 。
I下列描述中正确的是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)原子的核外电子排布式为;
(2)、
的晶体结构类型均与氯化钠的相同,
和
的离子半径分别为69
和78
,则熔点
(填"<"或">");
(3)晶胞中
和
的配位数分别为、;
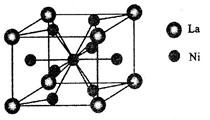
(4)金属镍与镧()形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为;

(5)丁二酮肟常用于检验:在稀氨水介质中,丁二酮肟与
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是键,碳氮之间的共价键类型是,氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在;
 ③该结构中,碳原子的杂化轨道类型有。
③该结构中,碳原子的杂化轨道类型有。
现有①NaCl ②金刚石 ③NH4Cl ④Na2SO4 ⑤干冰 ⑥NaOH六种物质,按下列要求回答:(注意(1)(3)两小题用序号填入)
(1)属于离子化合物的是 ,只有离子键的物质是 ,
晶体以分子间作用力结合的是 。
(2)①的电子式是__ _____,⑤的电子式是__ ______。
(3)熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是_______,
硬度最高的是 ,熔点最低的是 。
化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)Y的价电子轨道表示式为 ;
(2)YX2的电子式是 ,分子构型为 ,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是__ _____(填名称),键角为_______,中心原子的杂化形式为_______。
(5)元素X与Y的电负性的大小关系是___________(用元素符号填写,并填﹥、﹤、﹦),
X与Z的第一电离能的大小关系是___________。(用元素符号填写,并填﹥、﹤、﹦)