已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是
A.1 mol 由元素A、B组成的化合物一定含有18 mol e-
B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C.含D的盐溶液既可能显酸性,也可能显碱性
D.化合物AE与CE含有相同类型的化学键
在元素周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成______________外,也生成微量的________________。
(2)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇足量强碱溶液反应的离子方程式为_____________________________________________________________。
(3)科学家证实,BeCl2是共价化合物,可以设计一个简单实验证明,该实验方法是:____________________________________________________________________________。
用电子式表示BeCl2的形成过程:______________________________________________。
a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
b |
c |
d |
e |
f |
g |
| 原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
| 电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c与f反应可形成两个g分子。试写出:
(1)a粒子的核外电子排布式______________________________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱为:________>________ (用化学式表示)。
(3)d溶于水的电离方程式__________________________________________。
(4)c粒子是__________,f粒子是__________(用化学式表示)。
(5)g粒子的共价键数是_____而不是更多,说明共价键具有 性。
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①ⅡA族元素的价电子数__________。
②第三周期元素的最高正价__________。
③F-、Na+、Mg2+、Al3+的离子半径__________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①化合物XN的化学式为________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,组成元素的原子数目之比均为1∶1∶1,B是家庭“84”消毒液的有效成份。则化合物A中的化学键类型为__________,B的化学式为 。
③工业上制取单质M的化学方程式为 。
短周期主族元素A、B、C、D、E、F的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和。
请回答下列问题:
(1)B元素在元素周期表中的位置为____________ 。
(2)元素C和D可形成两种化合物D2C、D2C2,其中均含有的化学键类型是______________;元素E、F形成的最高价氧化物对应水化物的碱性强弱关系为_____>_____ (填化学式)。
(3)E的单质能与A的最高价氧化物发生置换反应,反应的化学方程式为_____________;
(4)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为______________.
A、B、C、D都是短周期元素,原子半径:D > C > A > B。已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍,下列说法正确的是:
A.A的元素符号为Be
B.B和D两种元素形成的化合物中只能含有离子键
C.C和D两元素的最高价氧化物的水化物相互反应生成盐和水
D.D2B和D2B2阴、阳离子个数比分别为1:2和1:1
下表列出了A~G7种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
C |
D |
E |
|
|
| 3 |
|
|
B |
|
|
|
F |
G |
| 4 |
A |
|
|
|
|
|
|
|
(1)分别写出A、D、G的元素符号: 、 、 ,其中化学性质最不活泼的是 (填元素符号);
(2)F的氢化物中化学键的类型是 ,F的最高价氧化物对应的水化物的化学式是 ;
(3)C、D、E三种元素中,氢化物种类最多的是 ;
(4)写出B与F形成的化合物发生水解反应的离子方程式 ;
短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族。下列说法正确的是
A.原子半径:D>B>C>A
B.元素A、B的氧化物具有相同类型的化学键
C.元素B和C的最高价氧化物对应水化物的碱性:B>C
D.B、C、D的最高价氧化物对应的水化物能相互反应
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
最外层电子数是内层电子数的3倍 |
| Y |
第三周期元素的简单离子中半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)元素T与X按原子个数比1:1形成的化合物B所含化学键为 ,该化合物的电子式为 。
(2)化合物A的溶液呈碱性,用离子方程式解释其原因: ,该化合物起消毒作用的微粒是 。
(3)将Y与Z形成的化合物的水溶液逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴边振荡),写出此过程中发生反应的离子方程式
、 。
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻,X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y.下列说法 正确的是 ( )
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C.YX2、M2Y都含有极性共价键 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
E、F、G、M是原子序数依次增大的短周期主族元素,E、G在周期表中的相对位置如下表。已知E元素最低负化合价的绝对值与其原子最外层电子数相等,F是地壳中含量最多的金属元素。下列说法错误的是( )
| E |
|
|
| |
|
G |
A.E和氢组成的化合物分子中只含有极性共价键
B.工业上用电解熔融的F的氧化物方法来制备F
C.G、M两元素的气态氢化物中,M的气态氢化物更稳定
D.E、F、G、M元素最高价氧化物对应的水化物中酸性最强的是M的最高价含氧酸
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1) A ;D (填元素名称)
(2)写出C、D两元素形成的常见化合物的电子式 ;写出由A、B两元素形成的18电子微粒中所含化学键类型 。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜。在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:
通入A单质的一极: ;
通入B单质的一极: 。
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用。请写出化合物X吸收NO2 时所发生反应的离子方程式: 。
四种短周期元素A、B、C、D,原子序数依次增大,结合下列信息:
(1)A的最高价氧化物对应的水化物E与其气态氢化物F反应,得到离子化合物G。
(2)B的焰色应呈黄色。
(3)C在同周期主族元素形成的简单离子中,离子半径最小.
(4)D最高正价与最低负价之和为零.
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)写出化合物F的电子式 ,结构式
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)
(4)下列可作为比较元素B和C金属性强弱的依据是 ( 填序号)
a.自然界中的含量b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
A的一种氢化物HA3可用于有机合成,其酸性与醋酸相似,体积和浓度均相等的HA3与B的最高价 氧化物对应的水化物的溶液混合,反应的化学方程式是 混合后溶液中离子浓度由大到小的顺序是
按要求填空
(一)、X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最处层电子数相同。回答下列问题:
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式 ;
(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键。此化合物可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为
(二)、在一定条件下,RO3nˉ和Iˉ发生反应,离子方程式为: RO3nˉ+6Iˉ+6H+==Rˉ+3I2+3H2O
RO3nˉ-中R元素的化合价为 ,R元素的原子最外层电子有 个。
(三)、Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1︰16,则x值是
(四)、已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为 。
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 |
元素性质或原子结构 |
| X |
原子的最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T |
与Z同周期,元素最高价是+7价 |
| W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的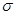 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如下图所示: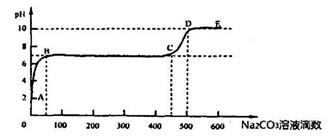
请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。