(8分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)Cl2的电子式是 。新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是 ,漂白粉是一种 (填“混合物”或“纯净物”)。
(2)碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是 。
(4)已知:X2(g)+H2(g)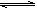 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。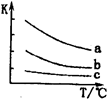
①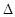 H表示X2与H2反应的晗变,H 0。(填“>”、“<”或“=”)
H表示X2与H2反应的晗变,H 0。(填“>”、“<”或“=”)
②曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与T的关系。
A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A_______,B_______,C_______。
(2)化合物C2A的电子式是______________,BA2的结构式是:_______________。
(3)A、C的最高价氧化物对应的水化物之间的离子反应方程式为 。
现有①NaCl ②金刚石 ③Na ④NaHSO4 ⑤干冰 ⑥碘片六种物质,按要求回答下列问题(填序号):
(1)属于离子化合物的是 ,只有离子键的物质是 ,晶体以分子间作用力结合的是 。
(2)NaHSO4熔融状态下电离,破坏了 键,写出电离方程式
(3)判断①、②、③、⑤熔沸点高低顺序
将下列物质进行分类(填序号)
①O2与O3 ②126C与136C ③白磷与红磷
④冰与水 ⑤H2、D2、T2 ⑥乙醇与二甲醚
⑦ 和
和
(1)互为同位素的是 (2)互为同素异形体的是
(3)互为同分异构体的是 (4)属于同一化合物的是
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物 PH4I是一种白色晶体,下列对它的描述中正确的是
| A.它是一种共价化合物 |
| B.在加热时此化合物可以分解为PH3和HI |
| C.这种化合物不能跟碱反应 |
| D.该化合物中只含有共价键 |
下列说法正确的是
①一块冰中氢、氧原子间只以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子、阴离子的相互吸引
④双原子单质分子中的共价健一定是非极性键
⑤非金属原子间不可能形成离子键
⑥离子化合物中可能有共价键
⑦共价化合物中可能有离子键
⑧两种不同非金属元素形成的共价化合物中只有极性键
| A.④⑥ | B.②④⑤ | C.①②③ | D.④⑥⑧ |
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用 语的表示方法中错误的是
A.次氯酸的电子式: |
B.S2-的结构示意图: |
| C.O—18的原子符号:188O |
| D.CO2分子的结构式:O=C=O |
下列说法正确的是
①含共价键的化合物一定是共价化合物
②气态单质分子中一定含有共价键
③由非金属元素组成的化合物可能是离子化合物
④离子化合物中一定含有离子键
⑤由不同元素组成的多原子分子里,一定只存在极性共价键
| A.②③ | B.②③⑤ | C.③④ | D.①②④ |
下列化学用语的书写,正确的是
A.氯原子的结构示意图: |
| B.氮气分子的结构式:N2 |
C.氯化镁的电子式: |
D.用电子式表示氯化氢分子的形成过程:  |
Ⅰ.用 表示原子:
表示原子:
(1)阳离子AXn+中共有x个电子,则该阳离子中含有的中子数目为 。
(2)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为 mol。
Ⅱ.有① 、
、 、
、 ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④ 、
、 、
、 四组微粒或物质。
四组微粒或物质。
回答下列问题:
(1)互为同位素的是 (填编号)。
(2)由①和④中微粒结合形成的水分子种类有 种。
Ⅲ.下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是 ;属于离子化合物,但含有共价键的是 。
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍。
请用化学用语回答:
(1)丙在元素周期表中的位置___________________________
(2)丁单质的电子式___________________________________
(3)乙的两种常见单质分别是__________,_______________
(4)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)________,________
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)__________。此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式_________________
(6)电解丁的钠盐饱和溶液的离子方程式________________________________
(7)若甲的元素符号为X。已知①X2(g)+2O2(g)==X2O4(l) △H="-19.5KJ/mol" ②X2H4(l)+O2(g)==X2(g)+2H2O(g) △H=-534.2KJ/mol则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式为______________________________________________________
(8分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的电子排布式为_____________________;
(2)写出与CO互为等电子体的分子__________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
①TiCl4为______化合物(填“离子”或“共价”)(已知电负性:Ti—1.5,Cl—3.0);
②TiCl4分子为正四面体形,则Ti为________杂化;
③配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 ;
(4)TiCl4在潮湿空气中水解的化学方程式为_____________________________________。
短周期元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)Y位于元素周期表中第___________周期第_______________族;
(2)写出X的质量分数为60%的化合物的化学式__________,该分子中中心原子采取______杂化,分子的空间构型为___________________;
(3)由元素氢、X、Y三种元素形成两种常见化合物的水溶液均呈酸性,试分别写出它们其分子式________、________,并比较它们酸性强弱:________________。
短周期元素D、E、X、Y、Z原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Z的价电子排布式为________________,EZ3分子的空间构型为_____________________;
(2)X与Z构成的分子是_________分子(填“极性”或“非极性”)。
(3)D和Y形成的化合物,其分子中的共价键为__________共价键(填“极性”或“非极性”),该分子中D原子的杂化方式为____________。
(4)写出一个验证Y与Z的非金属性强弱的离子反应方程式_________________________;
(5)金属镁和E的单质在高温下反应得到的产物与水反应生成两种碱性物质,该反应的化学方程式是_________。