已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如下图所示的反应。甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体。请回答下列问题。
(1)G的化学式为:____________________________________
(2)①反应的化学方程式为:____________,②反应的离子方程式为_______________。
(3)③反应的离子方程式为:______________________________,每生成 1 mol 乙气体,反应中转移____________mol 电子。
[6分]物质A~J均由短周期元素组成,并有如下图转化关系,A是常见液体,D、F为组成元素相同的无色气体,B、E、G、H是单质,且E是常见光太阳电池中的半导体材料,G、H呈气态,且H呈黄绿色。
请回答下列问题:
(1)A的电子式为 。
(2)I的化学式为 。
(3)B与C反应的化学方程式为 。
(4)H与氢氧化钠溶液反应的离子方程式为 。
(15分)无机化合物A主要用于药物制造。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C(标准状况)。气体C极易溶于水得到碱性溶液,电解无水B可生成一种短周期元素的金属单质D和氯气。由文献资料知道:工业上物质A可用金属D与液态的C在硝酸铁催化下反应来制备,纯净的A物质为白色固体,但制得的粗品往往是灰色的;物质A的熔点390℃,沸点430℃,密度大于苯或甲苯,遇水反应剧烈,也要避免接触酸、酒精。在空气中A缓慢分解,对其加强热则猛烈分解,在750~800℃分解为化合物E和气体C。
回答下列问题:
(1)A的化学式 。
(2)A与盐酸反应的化学方程式为 。
(3)A在750~800℃分解的方程式为 ,制得的粗品往往是灰色的,其可能的原因是 。
(4)久置的A可能大部分变质而不能使用,需要将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理: 。
(5)工业制备单质D的流程图如下:
①步骤①中操作名称是 。
②试用平衡移动原理解释步骤②中减压的目的是 。
(6)写出D的重氢化合物与水反应的化学方程式为 。
已知A为一种盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、
H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
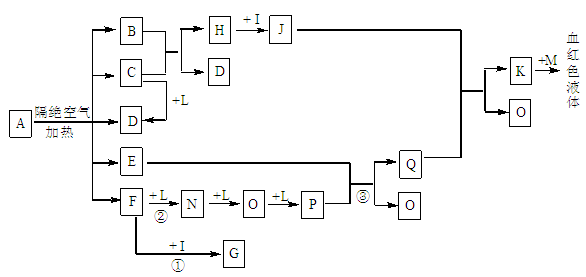
(1)写出D的电子式为_______________;
(2)写出反应②的化学方程式: ;反应③中氧化剂和还原剂的物质的量之比为_________________;
(3)将等体积、等浓度的G和F的溶液混合,溶液显碱性,则溶液中离子浓度从大到小的顺序为 ;
(4)检验J中阳离子的实验方法为 ;
(5)已知B中氧元素的质量分数为22.2﹪,且A分解产生的各物质的物质的量之比为n(B):n(C):
n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为__________________________。
在一定条件下可实现下图所示物质之间的转化:
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: 。
(3)写出B电解生成E和D的反应方程式: 。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式 ,该反应消耗了2 molG,则转移的电子数是 。
A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶于水得黄棕色溶液。这九种物质间反应的转化关系如图所示

(1)写出四种单质的化学式
A________ B_______ C______ D______
(2)写出H+B→G的离子方程式 ;
(3)写出G+I→H+D+E的化学方程式 ;
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉3.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.2mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2 =Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 保留到小数点后两位)。
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示;
④取少量甲溶液于试管中,加入过量NaOH溶液并加热;
回答下列问题:
(1)D在周期表中的位置 写出化合物AB3的电子式
(2)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比1:1,且1 mol 甲晶体中含有12 mol结晶水。则甲晶体的化学式为 。
(3)实验③中根据图像得V(0a):V(ab):V(bc)= 。
(4)实验④中离子方程式是 。
某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式__________。写出F的电子式___________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______________。
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图所示,“则A与B溶液”反应后溶液中的溶质化学式为________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是_____________
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是________________。
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_______________________。
物质A经下图所示的过程转化为含氧酸D,D为强酸,请回答下列问题:
(1)若A在常温下为气体单质则回答:
①A、C的化学式分别是:A________;C________。
②将C通入水溶液中,反应化学方程式为________________________。
(2)若仅A、B在常温下为气体且为化合物, 则回答:
①A的化学式是:A________。
②B生成C的化学方程式为________________________。
③一定条件下碳单质与D反应的方程式为________________________,该反应中D起到的作用是________________.
(3)若A在常温下为固体单质则回答:
①D的化学式是________;
②向含2mol D的浓溶液中加入足量的Cu加热,标准状况下产生的气体体积_______22.4L(填“大于”“等于”或“小于”),原因为_________________________________。
下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,D是氧化物,W是淡黄色固体。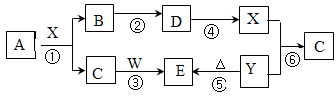
据此回答下列问题:
(1)B、C、D的化学式分别为:B 、C 、D ;从物质分类角度,上图所给物质中属于钠盐的是 (填写化学式)。
(2)上图所给物质在6个反应中只做还原剂的有 (填写化学式)。
(3)上图反应中不属于氧化还原反应的有 (填写序号)。
(4)写出A和X反应的化学方程式 ;若生成的B在标准状况下的体积为22.4L,则参加反应的A的物质的量为 ,反应中转移的电子数目为 。
(5)请写出C和W反应的化学方程式: 。
(6)请写出X和 Y反应的离子方程式: 。
(7分)某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
| |
肯定存在的离子 |
肯定没有的离子 |
| 化学式或离子符号 |
|
|
(2)写出沉淀A三种可能的情况:______________________________,若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为 。
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是_____________________。
某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性。它是以中学化学中常见物质为原料来生产的,图中C、M、K均含A元素,M的分子式为A(NH2)4;E为不含A 元素的氢化物,在空气中易形成白雾;G、F均为难溶于水的白色沉淀,H为氧化物,J为气体;其余物质均为中学化学中常见物质。(提示:NH3和H2O的化学性质在某些方面相似)

请回答下列问题:
(1)写出指定物质的化学式:A ,C ,F 。
(2)K的化学式为 。
(3)写出图中下列序号的化学方程式:
反应④ ;
反应⑤ 。
(4)写出图中反应⑥的离子方程式: 。
(9分)甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体。它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:
(1)甲物质为_____________(填化学式)。
(2)1mol乙和足量甲反应可生成______________mol B物质;1mol丙和足量甲反应可生成____________mol B物质。
(3)D能使湿润的有色布条褪色,其褪色原因是______________________。
(4)丙与溶液F反应的化学方程式为_____________________。
下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
(1)写出无色溶液中溶质的化学式: ;写出E的电子式 。
(2)写出C到白色沉淀的化学方程式是 。
(3)反应F→D的离子方程式是 。
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。