某无色混合气体可能含有CO2、CO、H2O(水蒸气)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):
①通过碱石灰时,气体体积变小;
②通过赤热的氧化铜时,固体变成红色;
③通过白色硫酸铜粉末时,粉末变成蓝色;
④通过澄清石灰水时,溶液变浑浊。
由此可以确定原混合气体中( )
| A.一定含有CO2、H2O,至少含有H2、CO中的一种 |
| B.一定含有H2O、CO,至少含有CO2、H2中的一种 |
| C.一定含有CO、CO2,至少含有H2O、H2中的一种 |
| D.一定含有CO、H2,至少含有H2O、CO2中的一种 |
A、B、C、D、E、F六种元素(前20号元素)的核电荷数依次增大。C是地壳中含量最高的元素;D的最高价氧化物的水化物分别能与E、F的最高价氧化物的水化物反应;E原子的最外层电子数是其最内层电子数的3倍;F元素是化学肥料中一种重要元素,其原子的次外层电子数与倒数第三层的电子数相等;A与F具有相同的最外层电子数;B元素的某种单质常作为干电池中的电极材料。试回答下列问题:
(1)由A、B两元素按原子个数之比为1︰1组成的某分子,其相对分子质量小于30,请写出实验室制备该物质的化学反应方程式 。
(2)D、E、F三种元素的原子半径由大到小顺序是 (用元素符号表示)。
(3)由C、D、E、F四种元素组成的某盐,可用作净水剂,也可用于制作膨化食品。该盐的化为 ,将该盐溶液与Ba(OH)2溶液按溶质物质的量之比1:2混合反应,此反应的离子方程式为 。
A~G各物质间的关系如下图所示,其中B、D为气体单质。则下列说法错误的是
A.若反应①在常温下进行,则1 mol A在反应中能转移1 mol电子
B.反应②的离子方程式为MnO2+4H++2Cl- Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
C.新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解
D.已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强
有一化合物X,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
 |
⑴X中滴入少量NaOH溶液的离子方程式为_______________________。
⑵B和D反应生成F的化学方程式为_____________________________。
⑶I转化为G的反应中,当有2 molG生成时,转移的电子数为_______。
⑷引发H和W反应的操作是____________________________________。
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是

| 选项 |
W |
X |
| A |
盐酸 |
Na2CO3溶液 |
| B |
Cl2 |
Fe |
| C |
CO2 |
Ca(OH)2溶液 |
| D |
NaOH溶液 |
AlCl3溶液 |
现有A、B、C、D、E、F六种中学常见的元素,其原子序数依次增大。①D的一种含氧酸根离子与H+结合生成D的单质、D的氧化物和水;该D的氧化物通入品红溶液,溶液褪色,加热溶液又变红色;②在短周期元素中,只有C的氧化物和烧碱反应生成的溶液与过量盐酸混合产生白色沉淀;③A与D的原子最外层电子数相同;④B的单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑤E有多种含氧酸,其氧化性与“同元素价态越高,其氧化性越强”一般规律相悖,它是生活调味品和农药的组成元素 ⑥E单质+F单质 红棕色烟,D单质+F单质
红棕色烟,D单质+F单质 黑色固体,A单质+F单质
黑色固体,A单质+F单质 黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
根据上述信息,回答下列问题:
(1)A的简单离子结构示意图为 ;具有强氧化性的E的含氧酸结构式为 ;
(2)向一定量的烧碱溶液中缓慢通入DA2,得到中性溶液,其溶质的化学式为 ;
(3)下列“根据”能证明B、F单质活泼性强弱的是 ;
a.根据它们分别与D单质反应产物的价态
b.根据它们最高价氧化物的水化物在氢氧化钠溶液中溶解情况
c.根据它们分别与盐酸反应产生气泡快慢
d.根据它们在空气中稳定性
(4)工业上冶炼C单质的化学方程式为 。
(5)CE4在湿空气中产生大量白雾,可以用于海战。写出发生的化学方程式: 。
(6)C、D、E最高价氧化物对应的水化物酸性强弱顺序为(用化学式表示): 。
化合物X、Y、Z之间有如图所示的转化关系。下列说法中不正确的是
| A.图中的每一步反应都是氧化还原反应 |
| B.钠与Y物质的反应属于氧化还原反应但不是离子反应 |
| C.X与Y的反应中,氧化剂和还原剂都是X |
| D.Z的水溶液能使酚酞试液变红 |
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下: 
该同学得出的结论正确的是
| A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素 |
| B.根据现象2可推出该固体粉末中一定含有NaNO2 |
| C.根据现象3可推出该固体粉末中一定含有Na2SO4 |
| D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
| A.X、Y、Z一定都是非金属单质 |
| B.X、Y、Z一定都是金属单质 |
| C.X、Y、Z中至少有一种是非金属单质 |
| D.X、Y、Z中至少有一种是金属单质 |
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。下列推断正确的是( )

A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
某ⅡA族元素是该族元素中在自然界最广泛存在的元素,常以化合物F的形式存在,其单质A可发生一系列如图所示的化学反应。下列说法正确的是
| A.D与H溶液反应后所得溶液的溶质成分有三种可能 |
| B.电解F与盐酸反应后的溶液以制取单质A |
| C.反应①、③中消耗相同H2O时反应转移电子数相同 |
| D.工业上常用F的悬浊液与Cl2反应制取漂白粉 |
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
| 选项 |
甲 |
乙 |
丙 |
丁 |
| A |
NaOH |
NaHSO3 |
Na2SO3 |
SO2 |
| B |
AlCl3 |
NaAlO2 |
Al(OH)3 |
NaOH |
| C |
Fe |
Fe(NO3)3 |
Fe(NO3)2 |
HNO3 |
| D |
C |
CO |
CO2 |
O2 |
元素X的单质及X与元素Y形成的化合物存在如图所示的关系(其中m ≠ n,且均为正整数)。下列说法正确的是
| A.X一定是金属元素 |
| B.(n-m)一定等于1 |
| C.由X生成1molXYm时转移的电子数目一定为4NA |
| D.三个化合反应一定都是氧化还原反应 |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )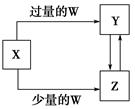
| 选项 |
W |
X |
| A |
盐酸 |
Na2CO3溶液 |
| B |
稀HNO3 |
Fe |
| C |
CO2 |
Ca(OH)2溶液 |
| D |
O2 |
Na |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )