物质A经下图所示的过程转化为含氧酸D,D为强酸,请回答下列问题:
(1)若A在常温下为气体单质则回答:
①A、C的化学式分别是:A________;C________。
②将C通入水溶液中,反应化学方程式为________________________。
(2)若仅A、B在常温下为气体且为化合物, 则回答:
①A的化学式是:A________。
②B生成C的化学方程式为________________________。
③一定条件下碳单质与D反应的方程式为________________________,该反应中D起到的作用是________________.
(3)若A在常温下为固体单质则回答:
①D的化学式是________;
②向含2mol D的浓溶液中加入足量的Cu加热,标准状况下产生的气体体积_______22.4L(填“大于”“等于”或“小于”),原因为_________________________________。
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和甲乙化合物之间存在如图所示的关系。下列说法一定正确的是
| A.X、Y、Z都是非金属单质 |
| B.X、Y、Z中至少有一种是金属单质 |
| C.若X、Y为金属单质,则Z必为非金属单质 |
| D.若X、Y为非金属单质,则Z必为金属单质 |
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。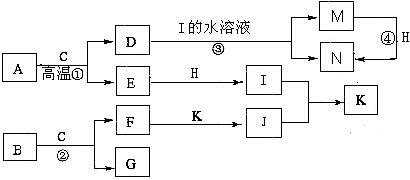
请填写下列空白
(1)写出化学式:D ,K 。
(2)写出②的离子方程式 。
(3)反应④不属于下列何种反应类型 (填字母序号)。
A. 化合反应 B. 氧化还原反应 C. 离子反应 D. 置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为 (填序号)。
A. KSCN溶液和氯水 B. 铁粉和KSCN
C. 浓氨水 D. 酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式 。
(7分)化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
已知:①上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是l:1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
②G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入,会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的主要原因。
③反应b、c是重要的化工反应,I是一种重要的化工原料。
④转化关系图中的部分变化经定量测定,得到如右图所示的固体产物的质量分数[ (%)]随温度[T(℃)]的变化曲线。
(%)]随温度[T(℃)]的变化曲线。
回答下列问题:
(1)写出A的化学式: ,D阴离子的示意图 。
(2)反应a的化学方程式为 。
(3)写出电解反应b的化学方程式,并标出电子转移的方向和数目: 。
(4)K与G在一定条件下可生成多种物质,既可获得经济效益,也可减少对环境的污染。若O是一种易挥发的液态燃料,有毒,误饮5~10mL会导致双目失明。则O的分子式为 。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为 。
②反应B+A→C的离子方程式为 。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为 (填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式: 。
下图表示有关物质之间的转化关系,A、C、E、G为非金属单质,其中A、G常温常压下为气态,E遇淀粉变蓝,K是一种食盐中常用的添加剂,L是常见的无色无味液体,I为淡黄色固体,J的焰色反应呈浅紫色(透过蓝色钴玻璃)。
(1)B、I代表的物质化学式分别为 、
(2)写出反应①②的离子方程式:
①
②
(3)选出实验室保存C单质的注意事项 (A.无色瓶 B.棕色瓶 C.橡胶塞 D.玻璃塞),除此之外还采取了什么特殊保存方法:
(4)已知A、C、E均能与G反应,按其反应条件要求由高到低顺序为 (用化学式表示)
(5)A与H溶液反应,其氧化产物和还原产物的物质的量的比为1:1,写出此反应的化学反应方程式:
(12分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
⑴ 下列物质的化学式为:A 、C 、D 。
⑵ 写出C与J反应生成H和G的离子方程式: 。
⑶ 写出I与H在点燃条件下反应生成A和J的化学方程式: 。
⑷ 写出D与足量的N反应生成E和F的化学方程式: 。
(12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为  。
。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g) △H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:  。
。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是 。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式: MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g) 2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。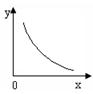
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
短周
 期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质已电解得到单质D的化学方程式为 ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为 。
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式 。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留, 所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
X、Z、Q、R 4种短周期元素原子序数的依次增大,Y是一种短周期主族非金属元素。化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol·L-1甲溶液的pH=13。工业上常用电解QR饱和溶液生产甲。请填写下列空白。
(1)Q的原子结构示意图为 。
(2)电解QR饱和溶液反应的离子方程式为 。
(3)常温下将R的单质通入甲溶液中,发生反应的离子方程式为 。
(4)①若Y与X组成的气体化合物乙在常温下遇XR气体时产生白烟,则乙的化学式为 ;YZ2与水反应的化学方程式:________________________________________
②若Y元素的单质能发生如图所示转化,则Y元素名称是 。YZ2的结构式为:_____________YZ2通过置换反应可生成Y的单质,该反应式为:____________________________________
③若Y元素的单质是一种淡黄色固体。写出Y的最高价氧化物的水化物的浓溶液与铜共热的化学方程式:______________ ____________________________________
④若Y的最高价氧化物可制光导纤维。写出工业生产Y单质的反应的化学方程式:____________________________________________________________
A~H有如图所示的转化关系,其中A是盐,B、C、D、E、F在常温常压下均是气态物质,反应④、⑤均在溶液中进行,转化中反应条件略去。
试回答下列问题:
(1)物质A的化学式为 ,电解时阴极反应式为 .
(2)反应③的化学方程式为 。
(3)反应⑤的离子方程式为 。
(4)镁与铝能形成多种合金,为了确定某合金样品的成分,小明同学设计如图所示的实验步 骤,确定合金组成。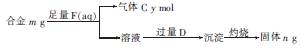
①能确定合金组成的数据组有 (填字母)。
a.m、n b.m、y c.n、y
②若合金中Mg的物质的量分数为x,金属总物质的量为7 mol,试在图中作出y随x变化的曲线。
某强酸性溶液X中含有Ba2+、A l3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42 —、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是____________________,不能确定的阳离子是___________,若要用实验证明该离子一定不存在,其最可靠的化学方法是________________________________________________________。
(2)沉淀G的化学式为_____________。
(3)写出下列反应的离子方程式:
①中生成气体A:_______________________________________。
②生成沉淀I:_______________________________________________。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________,沉淀C物质的量___________。