已知A、B为单质,C为化合物。
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加过量NaOH溶液,先出现浑浊后澄清,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
在下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他为化合物。试推断:
(1)写出下列物质的化学式:A:________B:________G:________
(2)写出下列反应的化学方程式或离子方程式:
C→F的离子方程式________________________________________
C→E的化学方程式________________________________________
H→I的化学方程式________________________________________
在如下图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质。C为一种黑色粉末,D为一种气体。
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为 ;D可能为 。
(2)若G为蓝色沉淀,H为难溶性盐,则I为 。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为 ;F可能为 。
(14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 ______________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式__________。
下面是有关物质的转化关系图,其中A为单质,E在常温下为液体,D是一种温室气体,C的相对分子质量为78。请回答相关问题。
(1)下列对C的结构、性质推断中不正确的是 ( )。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 |
| D.是一种碱性氧化物 |
(2)A的原子结构示意图为______________,H的电子式为______________,E的结构式为____________________。
(3)C和E反应生成H的离子方程式为__________________,反应中氧化剂与还原剂的物质的量之比为______。
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(部分产物已略去),下列说法错误的是
A.若X为Cl2,则C可能为Fe
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为C
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
某无色混合气体可能含有CO2、CO、H2O(水蒸气)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):
①通过碱石灰时,气体体积变小;
②通过赤热的氧化铜时,固体变成红色;
③通过白色硫酸铜粉末时,粉末变成蓝色;
④通过澄清石灰水时,溶液变浑浊。
由此可以确定原混合气体中( )
| A.一定含有CO2、H2O,至少含有H2、CO中的一种 |
| B.一定含有H2O、CO,至少含有CO2、H2中的一种 |
| C.一定含有CO、CO2,至少含有H2O、H2中的一种 |
| D.一定含有CO、H2,至少含有H2O、CO2中的一种 |
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸。请回答下列问题:
(1)写①的化学方程式______________________________________
(2)写反应②的离子方程式__________________________________
(3)写出将A通入石灰乳的化学方程式________________________
(4)在①②③④⑤⑥中,属于氧化还原反应的有:_______________(填编号)
化合物F是合成吲哚﹣2﹣酮类药物的一种中间体,其合成路线如图:
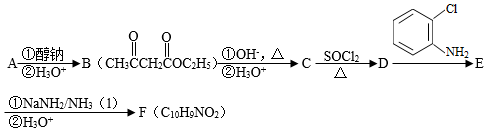
已知:Ⅰ.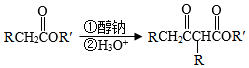
Ⅱ.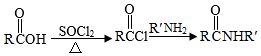
Ⅲ.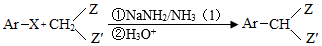
Ar为芳基;X=Cl,Br;Z或Z′=COR,CONHR,COOR等。
回答下列问题:
(1 )实验室制备A的化学方程式为 ,提高A产率的方法是 ; A的某同分异构体只有一种化学环境的碳原子,其结构简式为 。
(2)C→D的反应类型为 ; E中含氧官能团的名称为 。
(3)C的结构简式为 ,F的结构简式为 。
(4)Br2和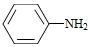 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以 和
和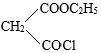 为原料合成
为原料合成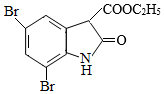 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
苯佐卡因是临床常用的一种手术用药。以甲苯为起始原料的合成路线如图。
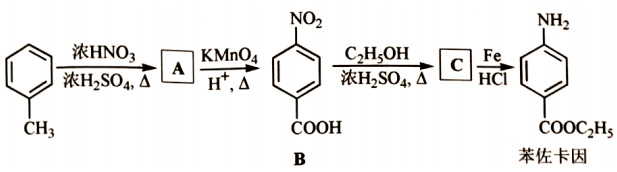
回答问题:
(1)甲苯分子内共面的H原子数最多为 个。
(2)A的名称是 。
(3)在A的同分异构体中,符合下列条件的是 ( 写出一种结构简式)。
①与A具有相同官能团
②属于芳香化合物
③核磁共振氢谱有5组峰
(4)B中官能团名称为 。
(5)B→C的反应方程式为 。
(6)反应过程中产出的铁泥属于危化品,处理方式为 ( 填编号)。
a.高温炉焚烧
b.填埋
c.交有资质单位处理
(7)设计以甲苯和丙三醇为原料合成3﹣苄氧基﹣1,2﹣丙二醇(  )的路线 (其他试剂任选)。
)的路线 (其他试剂任选)。
已知:在于HCl催化下丙酮与醇ROH反应生成缩酮。缩酮在碱性条件下稳定。在酸中水解为丙酮和醇ROH。
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
| A.X、Y、Z一定都是非金属单质 |
| B.X、Y、Z一定都是金属单质 |
| C.X、Y、Z中至少有一种是非金属单质 |
| D.X、Y、Z中至少有一种是金属单质 |
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。下列推断正确的是( )

A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
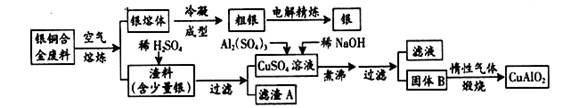
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为____mol CuAlO2(Cu 的相对原子量取63.5),至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。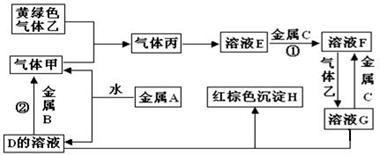
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A________、H__________、乙_______、C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是 ;
(2)写出下列反应的化学方程式:
反应①_____________________________________;
反应②_____________________________________。
(3)检验溶液G中金属阳离子的常用方法是 。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B ;C ;
沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式(是离子反应的写出离子方程式)
① ;② ;
③ ; ④ 。