A、B、C三种常见物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)。
(1)若A是一种两性氧化物,B的水溶液呈酸性,C的水溶液呈
碱性,请写出A、B、C三种物质中含有的同一种金属元素的原子
结构示意图_ B溶液显酸性的原因(用离子方程式
表示)  ,反应④的离子方程式 。
,反应④的离子方程式 。
(2)若A为一种金属单质时,反应①②③均为化合反应,反应④为置换反应。请写出③可能的离子方程式 和工业冶炼A的化学方程式_ 。
(3)若A、B、C是三种不同类别的气态物质,均能被同一种单
质氧化,写出实验室采用右图所示装置制取A的化学方程式________, 检验A气体是否集满的方法是 。
检验A气体是否集满的方法是 。
(4)若A、B、C是三种不同类别的固态物质,C是一种既含有离子
键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,
B是工业上制取A、C的原料。实验室保存少量单质A的方法是____ 。写出工业采用B制取C的离子方程式___ ;浓度均为0.5 mol.L-1的B、C溶液,导电能力比较强的是________(填化学式)溶液。
(5)若A、B均是可燃性物质,完全燃烧都生 成气体C,
成气体C,
常温下A溶液pH<7,将C通入A溶液中,pH值先增
大后减小。
①将C通入右图所示装置中,可以制得强电解质D的溶液,写出气体C发生的电极反应式
②该装置中H+的作用是 和
③若转移的电子数为6.02×1022时,左槽n(H+)的变化量
为________。
下表各组物质中,物质之间不可能实现如图所示转化的是( )
| 选项 |
X |
Y |
Z |
M |
| ① |
Al3+ |
Al(OH)3 |
[Al(OH)4]- |
NaOH |
| ② |
[Al(OH)4]- |
Al(OH)3 |
Al3+ |
HCl |
| ③ |
Fe |
FeCl2 |
FeCl3 |
Cl2 |
| ④ |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
| ⑤ |
NaOH |
Na2CO3 |
NaHCO3 |
CO2 |
| ⑥ |
NH3 |
NO |
NO2 |
O2 |
| ⑦ |
C2H5OH |
CH3CHO |
CH3COOH |
O2 |
| ⑧ |
H2S |
SO2 |
SO3 |
O2 |
A. 只有③ B. ③④ C. ④⑥⑧ D. ②③⑦
已知B是常见的金属单质,E为常见的气态非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
(1)F的电子式为 ,所含化学键为 ;
(2)反应①的离子方程式为 ;
(3)每生成1 mol K,反应放出98.3 kJ的热量,该反应的热化学方程式为 ;
(4)反应②的化学方程式为 ;
(5)化合物F与Na2S溶液反应,生成NaOH和S单质,试写出该反应的离子方程式为 。
A、B、C、D、E、F、G为常见物质,其中C为淡黄色固体。甲、乙、丙为常见气体。各物质的转化关系如下图所示。
回答下列问题:
(1)C的名称是 ;D的俗称__________;F的化学式 ;
A+甲→C的反应条件是 。
(2)在一定条件下,甲+乙→F,该反应属于 。
①氧化还原反应 ②非氧化还原反应 ③化合反应 ④分解反应
⑤复分解反应 ⑥置换反应 ⑦离子反应
(3)写出下列变化的离子方程式。
①A+F→E+乙: 
 。
。
②D+F+丙→G: 。
有A、B、C、D四种单质。在一定条件下,B可以和A、C、D化合生成化合物甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙每个分子中都含有10个电子,并且甲、乙、丙、丁有如下关系:
回答:
(1)单质B的化学式。
(2)单质A与化合物乙反应的化学方程式。
(3)根据化合物丙、丁中D 元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由。
元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
(1)若A可用于 自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则B的化学式可能是 ;实验室制取A的离子方程式为 。
自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则B的化学式可能是 ;实验室制取A的离子方程式为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,则反应①的化学方程式为 。
(3)若B有两性,则反应②的离子方程式是 。
(4)若D为空气质量预报必报的气体,A、B、C的的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是 (请写出 试剂名称)。
试剂名称)。
(5)若C是淡黄色固体,D是一种常见气体,则B→ C反应的化学方程式为 ,C的电子式为 。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应,回答下列问题: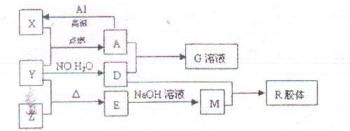
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为  ;R的化学式是 。
;R的化学式是 。
(2)已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量。写出该反应的热化学方程式:
(3)写出A和D的稀溶液反应生成G的离子方程式:
由短周期元素组成的中学常见的无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
A.若X是Na2CO3,C为分子构型为直线型,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-===H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是Na+[··············]2-Na+
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。

回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是________________。
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则反应①的离子方程式是________________。
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是________________。
 (4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是________________。
(4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是________________。
(5)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是________________。
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在 焓变△H=△H1+△H2。满足上述条件的X、Y可能是 ( )
焓变△H=△H1+△H2。满足上述条件的X、Y可能是 ( )
①C、CO ②S、SO2 ③Na、Na2O ④AICl3、Al(OH)3
⑤Fe、Fe( NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
淡黄色固体A和气体X存在如下转化关系:
请回答下列问题
(1)固体A的名称 ,X的化学式 。
(2)反应③的化学方程式为 。
(3)写出反应②④的离子方程式:
反应② 。
反应④ 。
(4)溶液 C中的阴离子主要是_
C中的阴离子主要是_ _________,检验该离子的实验操作为______________
_________,检验该离子的实验操作为______________
_________________________________。
(8分)W固体受热分解为三种产物,其产物之间又能发生反应的转化关系如下图所示,试推断并回答填空:
(1)写出下列物质的化学式:A________________ E____________
(2)写出W受热分解反应的化学方程式:_______________________________________
(3)写出D + A → W + E + H2O反应的离子方程式:
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、NaSO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A是________,B是________, C是________。