某化学小组同学利用以下药品及装置制取氨气并研究其性质(部分仪器已略去)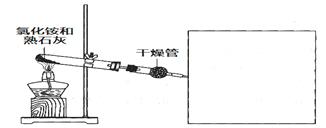
请回答:
(1)制备氨气的化学方程式是________________。
(2)干燥氨气可选用的试剂是________(填选项)。
a. 浓硫酸 b. 碱石灰 c. 氢氧化钠溶液
(3)在方框内绘制用小试管收集氨气的装置图。
(4)在实验室中检验氨气可选用________石蕊试纸。也可用玻璃棒蘸取浓盐酸,若观察到________________(填现象),即可证明,该反应的化学方程式是
________________________________________________________________________
如下图所示,是实验室制备某常见气体的实验装置,请填空:
(1) 该实验装置制备的常见气体是(填写化学式): 。
(2) 制备该气体的化学方程式是: 。
(3) 收集该气体的方法是: 。
(4) 检验该气体是否收集满的方法是:
。
(5) 将充满该气体的试管倒立于水槽中,可以看到的现象是:
。
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氯化氢气体应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)如果用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,打开止水夹,挤出胶头滴管中的水引发水上喷。该实验的原理 是 。
(4)如果用图2装置进行喷泉实验,上部烧瓶已装满干燥氯化氢气体,请说明引发喷泉的方法 。
(5)若至喷泉实验停止时,图1中剩有烧瓶容积1/5的气体;图2烧瓶中剩有烧瓶容积1/4的气体;则图2烧瓶中盐酸的物质的量浓度为 (两种气体均在标准状况下收集);图1烧瓶中氨水的物质的量浓度 (填“大于”、“小于”、“等于”)图2烧瓶中盐酸的物质的量浓度。
实验室中可用如图装置来制取干燥的氨气。
(1)写出A处发生反应的化学方程式 ;
(2)U形管B中所放的药品是 ;
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是 。
A、氢气 B、氧气 C、氯气 D、二氧化碳
(4)试管C的管口处要放置一小团棉花,放置棉花的作用是 ;
(5)资料显示:“氨气可在纯氧中点燃,反应生成氮气和水”。为验证此事实,某同学设计了一个实验方案,装置见D。请写出该反应的化学方程式 。
(18分)某学习小组利用如图实验装置制备Cu(NH3)xSO4·H2O.并测量x值。
【Cu(NH3)xSO4·H2O制备】见图1
(1)A中发生的化学反应方程式为 ;B中观察到的现象是 。
(2)C中CCl4的作用是 。
(3)欲从Cu(NH3)xSO4溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂 。
【x值的测量】见图2
步骤一:检查装置气密性,称取0 .4690 g晶体[M = (178+17x)g/mol]于锥形瓶a中
步骤二:通过分液漏斗向锥形瓶a中滴加l0%NaOH溶液
步骤三:用0.5000 mol/L的NaOH标液滴定b中剩余HCI,消耗标液16. 00 mL
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为 。
【x值的计算与论证】
(5)计算:x = ,
该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中 (任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设 (填“成立”或“不成立”),
针对假设l,你对实验的处理意见是 。
下列实验不合理的是 ( ) 
| A.证明非金属性强弱S>C>Si | B.四氯化碳萃取碘水中的碘 |
| C.制备并收集少量NO气体 | D.制备少量氧气 |
实验室用下图所示装置进行氨气实验。

(1)试管中发生反应的化学方程式是_________________。
(2)干燥管中盛放的干燥剂是_______________(填名称)。
(3)请在方框中画出收集一烧瓶氨气的装置。
(4)检验氨气是否收集满,可选用_________试纸,实验现象是_______________。
(5)用右图装置做喷泉实验。轻轻挤压滴管,使少量水进入烧瓶,打开止水夹,观察到的现象是 ,出现这一现象的原因是 。
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl ="=" 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应得到的氧化产物是____________(填化学式)。
(4)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意___________________________________________________.
(1)氨气是重要的化工原料.实验室可用浓氨水和 来制取氨气.
a.烧碱 b.生石灰 c.氯化铵
(2)某实验小组设计了下列装置进行氨的催化氧化实验.

①盛放氨水的实验仪器的名称为 ;在加热条件下,硬质玻璃管中发生反应的化学方程式为 .
②实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是 .
③烧杯中盛有NaOH溶液的作用是 .
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:

【实验探究】
(1)A中的反应 (填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体 (只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
【知识应用】
(9)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救为法?
请完成有关氨气的问题。
(1)实验室常用下列装置和选用的试剂制取NH3,其中正确的是__________(填序号)。 
(2)若实验室收集NH3 要采用法__________。
(3)若检验NH3 ,可用__________。
(本题共12分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、锌粒、稀盐酸、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题: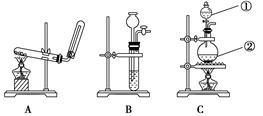
(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;通常选用C装置制取的气体有________。
(2)标号为①、②的仪器名称依次是________、______________。
(3)写出利用上述有关药品制取Cl2的离子方程式:_______________________________。
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
(1)A点前样品与NaOH反应的离子方程式为__________________________________
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的________。
(3)样品中(NH4)2CO3的质量分数是________%(保留一位小数)。